题目内容
【题目】(8分)同学们做甲、乙两个中和反应实验的探究,如图所示:
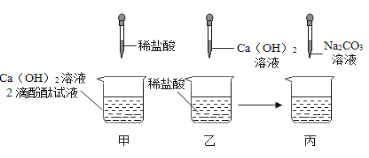
(1)甲实验恰好中和,则该溶液中的溶质是_____ (填化学式)。
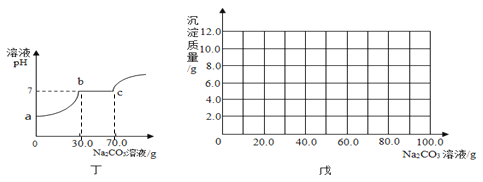
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液,如图丙,溶液pH的变化如图丁,则与CaCl2反应的碳酸钠溶液的质量为_____g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
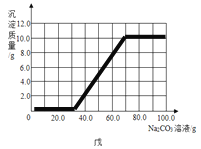
(3)根据计算所得数据在图戊中画出产生沉淀的曲线。
【答案】(1)CaCl2 (2)40g 18.5%
(3)
【解析】
试题分析:甲实验恰好中和,则该溶液中的溶质只有氯化钙,溶液pH的变化如图丁,因为开始是盐酸和碳酸钠的反应,当溶液的PH变为7时,说明氯化钙开始和碳酸钠反应,与CaCl2反应的碳酸钠溶液的质量为70克-30克=40克。
据题意,设参加反应的CaCl2的质量为 x,
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
x 40g×26.5%
111/106= x /40g×26.5%
解得:x=11.1g 该CaCl2溶液的溶质质量分数为:11.1 g/60g×100%≈18.5%
设:滴加质量分数26.5%的Na2CO3溶液70g时(此时与CaCl2溶液反应的Na2CO3溶液质量为40g),生成沉淀的质量为x,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100
40g×26.5% y
106/100= 40g×26.5%/ y
解得y=10g

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目