题目内容
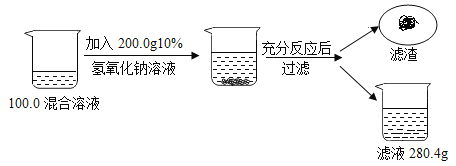
【题目】为了测定某氯化钠和氯化铜混合溶液中氯化铜的质量分数,兴趣小组的同学们进行如下实验:
(1) NaOH由 种元素组成;
(2) NaOH的相对分子质量是 。
(3) NaOH中氧元素的质量分数为 %;
(4)滤渣的质量为 g;
(5)计算原混合溶液中氯化铜的质量分数。(要求写出计算过程)
【答案】(1)三
(2)40
(3)40
(4)19.6g
(5)27%
【解析】
(1)氢氧化钠由Na、O、H三种元素组成;
(2)氢氧化钠的相对分子质量是:23+16+1=40;
(3)氢氧化钠中氧元素的质量分数为:![]() ;
;
(4)向氯化钠和氯化铜的混合溶液中加入氢氧化钠,氯化铜能与氢氧化钠反应生成氢氧化铜和氯化钠,滤渣的质量为:100g+200g-280.4g=19.6g;
(5)解:设原混合溶液中氯化铜的质量分数为x
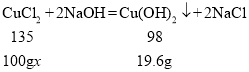
![]() x=27%
x=27%
答:原混合溶液中氯化铜的质量分数为27%。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】关于下列事实的解释不正确的是( )
选项 | 事实 | 解释 |
A | 10mL酒精和10mL水混合后体积小于20mL | 分子之间有间隔 |
B | 稀硫酸和稀盐酸化学性质相似也存在差异 | 溶液中都含有H+ , 也存在不同的SO42-、Cl-离子 |
C | 酒精溶液不导电 | 溶液中没有自由移动的带电粒子 |
D | 化肥硫酸铵不能和熟石灰混放或混用 | 硫酸铵与熟石灰发生中和反应 |
A.A B.B C.C D.D
【题目】化学小组同学利用下图装置分别完成2个实验。
序号 | 甲 | 乙 | 分液漏斗 |
1 | 大理石 | 澄清石灰水 | 稀盐酸 |
2 | 二氧化锰 | 80℃热水及一小块白磷 | 过氧化氢溶液 |

(1)实验1:打开b和a,将分液漏斗中过量的盐酸注入,关闭a,此时乙中反应的化学方程式是_____,一段时间后,关闭b,观察到乙中液体变澄清,产生此现象的原因是_____。
(2)实验2:观察到乙中白磷的现象是_____;打开b和a,当分液漏斗中的过氧化氢溶液全部注入后,关闭a,观察到乙中白磷的现象是_____。关闭b,一段时间后,白磷的现象及原因是_____。