题目内容
【题目】向200.0 g AgNO3溶液中加入Fe和Cu的混合粉末X g,搅拌,充分反应后过滤、洗涤、干燥得32.4 g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是
A.干燥所得固体中加入稀盐酸有气体生成B.混合粉末的质量范围是8.4<X<9.6
C.滤液的质量一定大于167.6 gD.原AgNO3溶液的溶质质量分数是25.5%
【答案】BC
【解析】
向硝酸银溶液中加入铁和铜的混合粉末,铁先与硝酸银反应生成硝酸亚铁和银,待铁完全反应后,铜再与硝酸银反应生成硝酸铜和银,充分反应后过滤、洗涤、干燥,向滤液中滴加NaCl溶液,产生白色沉淀,氯化钠能与硝酸银反应生成氯化银白色沉淀,说明滤液中硝酸银过量,说明铁、铜已经完全反应,故所得的32.4g固体为银。
A、由分析可知,铁、铜已经完全反应,铁与硝酸银反应生成硝酸亚铁和银,铜与硝酸银反应生成硝酸铜和银,故所得固体为银,在金属活动性顺序里,银位于氢之后,不与稀盐酸反应,不会有气泡生成,不符合题意;
B、由分析可知,充分反应后过滤、洗涤、干燥,所得的固体为银,如果混合固体全部是铁,设铁的质量为a

![]() a=8.4g
a=8.4g
如果混合固体全部是铜,设铜的质量为b
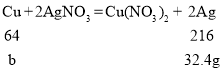
![]() b=9.6g
b=9.6g
该混合固体为铜、铁的混合物,故混合粉末的质量范围是8.4<X<9.6,符合题意;
C、根据质量守恒定律,化学反应前后,物质的总质量不变,向200.0 g AgNO3溶液中加入Fe和Cu的混合粉末X g,![]() 、
、![]() ,硝酸银溶液的质量+混合粉末质量X=滤液的质量+反应后固体的质量,故200g+Xg=滤液的质量+32.4g,滤液的质量=167.6g+Xg,故滤液的质量一定大于167.6 g,符合题意;
,硝酸银溶液的质量+混合粉末质量X=滤液的质量+反应后固体的质量,故200g+Xg=滤液的质量+32.4g,滤液的质量=167.6g+Xg,故滤液的质量一定大于167.6 g,符合题意;
D、硝酸银溶液的质量已知,但是硝酸银过量,无法求出硝酸银溶液中溶质的质量,即无法求出硝酸银溶液的溶质质量分数,不符合题意。
故选BC。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】通过学习,我们已经了解了常见金属在溶液中的活动性顺序。铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、Al、Cu的金属活动性顺序进行探究,过程如下:
(提出假设)
(1)对三种金属的活动性顺序提出三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.________________
(查阅资料)该研究小组必须查阅的资料是_________(填序号)
①Cr、Al、Cu三种金属的密度②Cr能否与酸反应③Cr、Al、Cu三种金属导电性
(设计实验)
同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如表:
金属 | Cr | Al | Cu |
与盐酸反应现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
(控制实验条件)
(2)打磨三种金属的目的____________;上述实验使用等浓度的盐酸溶液的理由是___________________。
(得出结论)
(3)原假设中正确的是_______(填假设中“a”“b”或“c”).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式:___________。
(结论应用)
(4)根据探究结果,写出Al丝与CuSO4溶液反应的化学方程式_______________,并写出反应的实验现象___________________。