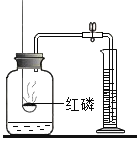
题目内容
【题目】在学习金属的性质时,老师要求同学们根据实验室所提供的药品探究锌、铁、铜三种金属的活动性强弱。探究金属活动性强弱一般采用金属与酸的反应:根据能否与酸反应,以及与酸反应的剧烈程度来判断;于金属与化合物溶液的反应:根据能否将其置换出来,来判断金属的活动性强弱。
(提出问题)三种金属的活动性强弱是怎样的呢?
提供的药品有:铁粉、铜丝、锌粒、20%稀硫酸、CuSO4 溶液、ZnSO4 溶液、FeSO4 溶液
同学们分成甲、乙两组进行了实验。
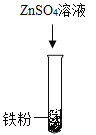
(1)甲组同学设计如下方案进行实验:
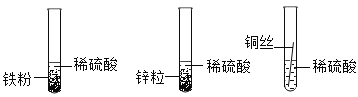
立刻有同学提出反对,理由是_____。
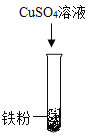
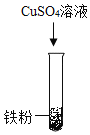
(2)乙组同学设计如下方案进行实验:
实验步骤 |
|
|
实验现象 | 无明显变化 | _____ |
实验结论 | 三种金属的活动性强弱为_____ | |
发生反应的化学方程式为_____。
(3)乙组同学将两支试管中的物质倒在一个洁净的烧杯中,充分反应后过滤,同学们又对滤渣的成分展开了探究。
(作出猜想)猜想一:滤渣中一定有铜 猜想二:_____
实验步骤 | 向滤渣中加入一定量稀硫酸 |
实验现象 | _____ |
实验结论 | 猜想二正确 |
此时经过以上实验后的滤液中一定含有_____(填化学式)。
(拓展延伸)通过学习同学们掌握了比较金属活动性强弱的正确方法,同时又选择了另一组试剂_____,验证了三种金属的活动性强弱。
【答案】铁粉和锌粒形状不同 析出红色固体,蓝色溶液变成浅绿色 锌>铁>铜 Fe+CuSO4═FeSO4+Cu 滤渣中有铜、铁 有气泡产生 ZnSO4、FeSO4 锌片、铜片、硫酸亚铁溶液
【解析】
(1)有同学提出反对,理由:铁粉和锌粒形状不同,无法比较其活泼性。
故填:铁粉和锌粒形状不同。
(2)铁粉和硫酸锌溶液混合无明显现象,说明锌比铁活泼,铁和硫酸铜混合,析出红色固体,蓝色溶液变成浅绿色,是因为铁和硫酸铜反应生成硫酸亚铁和铜,说明铁比铜活泼,实验过程如下所示:
实验步骤 |
|
|
实验现象 | 无明显变化 | 析出红色固体,蓝色溶液变成浅绿色 |
实验结论 | 锌>铁>铜 | |
发生反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
故填:Fe+CuSO4═FeSO4+Cu。
(3)[作出猜想]
猜想一:滤渣中一定有铜,猜想二:滤渣中有铜、铁。
故填:滤渣中有铜、铁。
[进行实验]
向滤渣中加入稀硫酸,产生气泡,是因为铁和稀硫酸反应生成硫酸亚铁和氢气,实验过程如下所示:
实验步骤 | 实验现象 | 实验结论 |
向滤渣中加入一定量稀硫酸 | 有气泡产生 | 猜想二正确 |
此时滤液中含有的溶质是没有反应的ZnSO4和反应生成的FeSO4。
故填:有气泡产生;ZnSO4、FeSO4。
(4)可以选择锌片、铜片、硫酸亚铁溶液,这是因为把锌片、铜片分别伸入硫酸亚铁溶液中时,锌片表面会析出固体,是因为锌和硫酸亚铁反应生成硫酸锌和铁,说明锌比铁活泼,铜片表面无明显现象,说明铜不能和硫酸亚铁反应,进一步说明铁比铜活泼。
故填:锌片、铜片、硫酸亚铁溶液。

 阅读快车系列答案
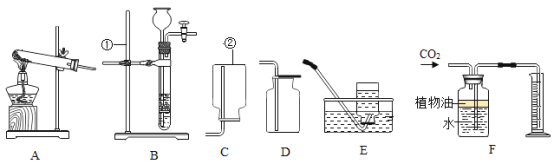
阅读快车系列答案【题目】实验装置及实验操作是化学实验的基本内容
(1)请将体现下列实验操作目的正确选项,填在对应的横线上。
A防止药品污染 B防止试管破裂 C减少实验误差
加热试管时,先均匀加热后集中加热____________,滴管使用后,及时清洗并放在试管架上____________,量取液体时,视线与凹液面最低处保持水平__________。
(2)下列实验装置中均有水,请根据实验解释水在其中的主要作用。
A | B | C | D | |
实验装置 | 铁氧气中燃烧
| 测定空气中氧气含量
| 水通电分解
| 探究燃烧的条件
|
解释 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | _____________ | _____________ | _____________ |