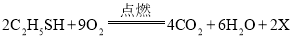题目内容
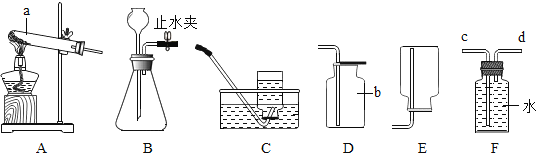
【题目】下列为实验室常用的实验装置,回答问题:
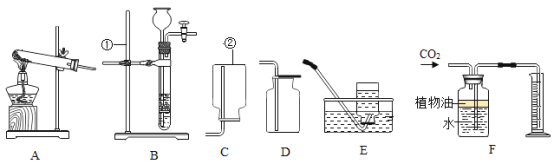
(1)写出带有标号仪器的名称:①_____;
(2)用锌和稀硫酸制取氢气,应选用的发生装置是_____(填序号,下同),如果也用该发生装置制取氧气,则发生反应的化学方程式是_____。
(3)实验室常用稀盐酸和石灰石反应制CO2,该反应的化学方程式_____;此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式_____,若用此法来制取CO2,应选用的发生装置为_____,收集装置为_____。
(4)上图F所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是_____,植物油上方原有的空气对实验结果_____(填“有”或“无”)明显影响。
【答案】铁架台 B  CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑ ![]() A D 防止二氧化碳溶于水 无
A D 防止二氧化碳溶于水 无
【解析】
锌和稀硫酸反应生成硫酸锌和氢气,过氧化氢在二氧化锰催化作用下生成水和氧气,碳酸钙和稀盐酸反应生成氯化钙、水和氧气,碳酸氢钠加热生成碳酸钠、二氧化碳和水。
(1)标号仪器的名称:①是铁架台。
(2)锌和稀硫酸反应生成硫酸锌和氢气,用锌和稀硫酸制取氢气,反应在常温下进行,故应选用的发生装置是B,如果也用该发生装置制取氧气,过氧化氢在二氧化锰催化作用下生成水和氧气,则发生反应的化学方程式是 。
。
(3)碳酸钙和稀盐酸反应生成氯化钙、水和氧气,实验室常用稀盐酸和石灰石反应制CO2,该反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式为![]() ,若用此法来制取CO2,反应需要加热,故应选用的发生装置为A,二氧化碳易溶于水,密度比空气大,故收集装置为D。
,若用此法来制取CO2,反应需要加热,故应选用的发生装置为A,二氧化碳易溶于水,密度比空气大,故收集装置为D。
(4)上图F所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是防止二氧化碳溶于水,二氧化碳不和空气中成分反应,植物油上方原有的空气对实验结果无显影响。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】小丽通过阅读说明书了解到家用制氧机的工作原理如下:

加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气。减压时,分子筛将所吸附的氮气排放。整个过程中,分子筛并不消耗。小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验I:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气。
(实验记录)
实验步骤 | 实验现象 | 文字表达式 |
取一只250 mL的集气瓶,用排水法收集一瓶所带气体,然后把一小块燃着的木炭插入集气瓶中 | 木炭燃烧得更旺 | 文字表达式I |
表中,文字表达式为_____
(实验结论)收集的气体是纯净的氧气。
(实验反思1)老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气。该实验不能证明所收集气体为纯净氧气的原因是___________。
实验II:测定小丽所带气体中氧气的含量。
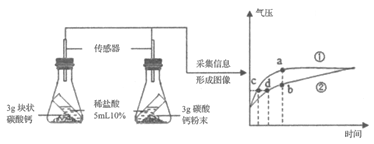
同学们在老师的指导下用250 mL 集气瓶设计了如下图所示装置,进行实验,并重复多次。
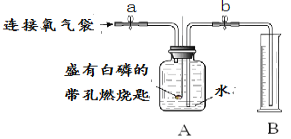
(实验记录 )
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性 | 装置的气密性良好 | |
② | 加入药品,瓶装满水,将装置连接固定 | ||
③ | 打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b | A中水进入到B中,B中水的体积为200 mL。 | 收集200 mL气体(由压强差引起的误差忽略不计) |
④ | 用凸透镜聚光引燃白磷 | 燃烧,产生大量白烟 | |
⑤ | 待白磷熄灭并冷却到室温,操作I | 现象I | 小丽收集的气体不是纯净的氧气 |
表中,操作I是____________,现象I是_________。上述反应文字表达式是_________。
(数据记录)
实验次序 | 1 | 2 | 3 | 4 | 5 |
B中剩余水体积/mL | 100 | 42 | 39 | 41 | 38 |
(数据处理)已知,在上表数据中,第1组数据偏差较大,存在明显误差,在数据处理时应删去。取余下四次平均值计算,小丽所带气体中氧气的体积分数为________________% 。
(实验反思2)
(1)这台制氧机制氧气的过程发生的变化属于_____(填“物理变化”或“化学变化”)。
(2)导致第1组数据产生较大误差的可能原因是_________________。
【题目】在学习金属的性质时,老师要求同学们根据实验室所提供的药品探究锌、铁、铜三种金属的活动性强弱。探究金属活动性强弱一般采用金属与酸的反应:根据能否与酸反应,以及与酸反应的剧烈程度来判断;于金属与化合物溶液的反应:根据能否将其置换出来,来判断金属的活动性强弱。
(提出问题)三种金属的活动性强弱是怎样的呢?
提供的药品有:铁粉、铜丝、锌粒、20%稀硫酸、CuSO4 溶液、ZnSO4 溶液、FeSO4 溶液
同学们分成甲、乙两组进行了实验。
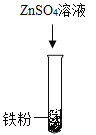
(1)甲组同学设计如下方案进行实验:
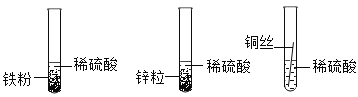
立刻有同学提出反对,理由是_____。
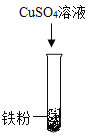
(2)乙组同学设计如下方案进行实验:
实验步骤 |
|
|
实验现象 | 无明显变化 | _____ |
实验结论 | 三种金属的活动性强弱为_____ | |
发生反应的化学方程式为_____。
(3)乙组同学将两支试管中的物质倒在一个洁净的烧杯中,充分反应后过滤,同学们又对滤渣的成分展开了探究。
(作出猜想)猜想一:滤渣中一定有铜 猜想二:_____
实验步骤 | 向滤渣中加入一定量稀硫酸 |
实验现象 | _____ |
实验结论 | 猜想二正确 |
此时经过以上实验后的滤液中一定含有_____(填化学式)。
(拓展延伸)通过学习同学们掌握了比较金属活动性强弱的正确方法,同时又选择了另一组试剂_____,验证了三种金属的活动性强弱。