题目内容
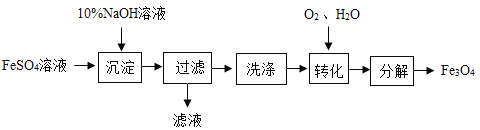
【题目】自来水厂净水过程的主要操作流程如图,请回答下列问题:
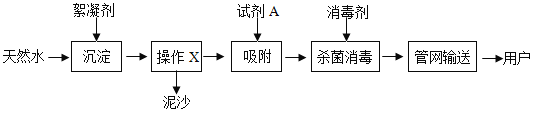
(1)取水后加入絮凝剂明矾的作用是____________________;
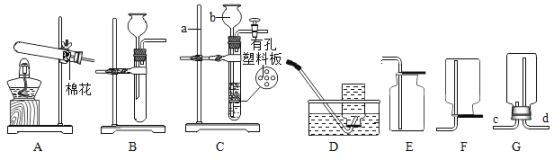
(2)实验室进行操作X需要的一种玻璃仪器为__________;试剂A的名称为__________。
(3)二氧化氯为常用消毒剂,其化学式为__________。
【答案】吸附杂质,使杂质沉降 烧杯、漏斗、玻璃棒(三选一即可) 活性炭 ClO2
【解析】
(1)取水后加入絮凝剂(明矾)的作用是利用絮凝剂溶于水后形成胶状物对杂质的吸附作用,使其形成沉淀,从而达到净水的效果。故答案为:吸附杂质,使杂质沉降;
(2)由自来水厂净水流程图可得知,经过操作X,可以将液体水和固体泥沙分离出来,即固液分离操作。则该操作X的名称为过滤。实验室进行过滤操作时,会用到三种玻璃仪器,漏斗、烧杯、玻璃棒。而在吸附池中,加入试剂A,达到吸附的效果,则A为活性炭,因为活性炭具有吸附性,可以吸附水中的色素和异味。故答案为:烧杯、漏斗、玻璃棒(三选一即可),活性炭;
(3)二氧化氯的读法应该是从右向左读。数字应该在元素符号的右下角,表示一个分子中原子的个数,元素对应数学元素符号即可。所以由此可分析出,二氧化氯的化学式为:ClO2。故答案为:ClO2。

【题目】在学习金属的性质时,老师要求同学们根据实验室所提供的药品探究锌、铁、铜三种金属的活动性强弱。探究金属活动性强弱一般采用金属与酸的反应:根据能否与酸反应,以及与酸反应的剧烈程度来判断;于金属与化合物溶液的反应:根据能否将其置换出来,来判断金属的活动性强弱。
(提出问题)三种金属的活动性强弱是怎样的呢?
提供的药品有:铁粉、铜丝、锌粒、20%稀硫酸、CuSO4 溶液、ZnSO4 溶液、FeSO4 溶液
同学们分成甲、乙两组进行了实验。
(1)甲组同学设计如下方案进行实验:
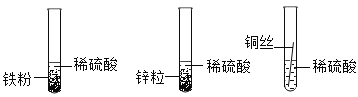
立刻有同学提出反对,理由是_____。
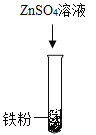
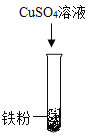
(2)乙组同学设计如下方案进行实验:
实验步骤 |
|
|
实验现象 | 无明显变化 | _____ |
实验结论 | 三种金属的活动性强弱为_____ | |
发生反应的化学方程式为_____。
(3)乙组同学将两支试管中的物质倒在一个洁净的烧杯中,充分反应后过滤,同学们又对滤渣的成分展开了探究。
(作出猜想)猜想一:滤渣中一定有铜 猜想二:_____
实验步骤 | 向滤渣中加入一定量稀硫酸 |
实验现象 | _____ |
实验结论 | 猜想二正确 |
此时经过以上实验后的滤液中一定含有_____(填化学式)。
(拓展延伸)通过学习同学们掌握了比较金属活动性强弱的正确方法,同时又选择了另一组试剂_____,验证了三种金属的活动性强弱。