题目内容
(1)(8分)小丽在购买的袋装薯片中发现有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,小丽打算进行实验探究,请你一同参与。
《实验目的》证实灰白色粉末中含有CaCO3和Fe。
《查阅资料》①氢气具有还原性,能夺取某些金属氧化物中的氧,使金属还原,
②白色的无水硫酸铜遇水变成蓝色。
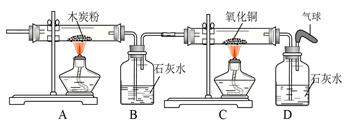
《实验设计》装置如下图所示:

《实验预测与分析》
①若要证实样品中含有CaCO3,B中观察到的实验现象是_____________________,B中发生反应的化学方程式为_____________________。
②若要证实样品中含有Fe,D中应观察到的实验现象是________________________,E中应观察到的实验现象是________________________。
③看了小丽的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式__________________。
④小丽认为棕红色粉末Fe2O3也能与盐酸反应,请你写出反应的化学方程式___________________________。
(2)(5分)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜中铜的质量分数,现取20g该样品粉碎,加入到100g稀硫酸中,恰好完全反应,反应后测得烧杯中剩余物的总质量为119.6克。
①反应生成氢气的质量是__________________,
②黄铜样品中铜的质量分数是_______________,
③计算稀硫酸中溶质的质量分数。
《实验目的》证实灰白色粉末中含有CaCO3和Fe。
《查阅资料》①氢气具有还原性,能夺取某些金属氧化物中的氧,使金属还原,
②白色的无水硫酸铜遇水变成蓝色。
《实验设计》装置如下图所示:

《实验预测与分析》
①若要证实样品中含有CaCO3,B中观察到的实验现象是_____________________,B中发生反应的化学方程式为_____________________。
②若要证实样品中含有Fe,D中应观察到的实验现象是________________________,E中应观察到的实验现象是________________________。
③看了小丽的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式__________________。
④小丽认为棕红色粉末Fe2O3也能与盐酸反应,请你写出反应的化学方程式___________________________。
(2)(5分)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜中铜的质量分数,现取20g该样品粉碎,加入到100g稀硫酸中,恰好完全反应,反应后测得烧杯中剩余物的总质量为119.6克。
①反应生成氢气的质量是__________________,
②黄铜样品中铜的质量分数是_______________,
③计算稀硫酸中溶质的质量分数。
19.(1)(8分 方程式每空2分,其余每空1分)
①澄清石灰水变浑浊 Ca(OH)2+CO2=CaCO3↓+H2O
②黑色固体变成红色 白色固体变成蓝色
③CaO或Ca(OH)2
④Fe2O3+6HCl=2FeCl3+3H2O
(2)(5分 )
①0.4g (1分)
②35% (1分)
③解:设稀硫酸中溶质的质量为x
Zn + H2SO4 = ZnSO4 + H2↑ (1分)
98 2
x 0.4g
98:x=2:0.4g
解得:x=19.6g (1分)
稀硫酸中的溶质的质量分数=19.6g/100g*100%=19.6% (1分)
①澄清石灰水变浑浊 Ca(OH)2+CO2=CaCO3↓+H2O
②黑色固体变成红色 白色固体变成蓝色
③CaO或Ca(OH)2
④Fe2O3+6HCl=2FeCl3+3H2O
(2)(5分 )
①0.4g (1分)
②35% (1分)
③解:设稀硫酸中溶质的质量为x
Zn + H2SO4 = ZnSO4 + H2↑ (1分)
98 2
x 0.4g
98:x=2:0.4g
解得:x=19.6g (1分)
稀硫酸中的溶质的质量分数=19.6g/100g*100%=19.6% (1分)
若含有碳酸钙会和盐酸反应生成二氧化碳,二氧化碳可以使澄清石灰水变浑浊;有铁会和盐酸反应生成氢气,氢气可以还原氧化铜,使黑色的氧化铜变成红色,同时生成水,使无水硫酸铜变蓝。将20g该样品加入到100g稀硫酸中,反应后烧杯中剩余物的总质量为119.6克,前后差了20+100-119.6=0.4克,就是氢气的质量,氢气跑到空气中去了,所以总质量在减少。根据氢气质量可以求出锌的质量为13克,则铜的质量为7克,铜的质量分数7/20=35%。

练习册系列答案
相关题目