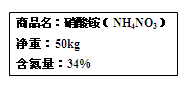
题目内容
(12分)小明同学在整理厨房时不小心将一瓶醋打翻,醋洒在火炉旁的一堆草木灰上,发现有大量的气泡生成。激发了兴趣,于是他决定与学习小组的同学,对草木灰的成分进行探究。
[探究活动一] 根据所学酸碱盐知识,同学们猜想草木灰中含有能与酸反应产生气体的盐类物质,于是,设计并进行如下图所示的实验。观察到锥形瓶A内有大量的气泡冒出,试管B中澄清的石灰水变浑浊。
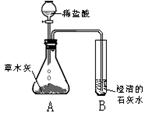
根据上述实验现象推断:产生的气体中含有 ,
试管B中有关反应的化学方程式为 。
[探究活动二]资料摘要Ⅰ:草木灰中的主要成分是碳酸钾,碳酸
钾的水溶液和碳酸钠溶液酸碱性相似。
(1)向碳酸钾的水溶液中滴入酚酞试液,溶液显 色。
(2)请你写出上述“探究活动一”中,锥形瓶A内发生的一个反应的化学方程式: 。
(3)某同学欲测定这些草木灰中碳酸钾的含量,称天平称取69g试样于烧杯中,加入100g稀盐酸恰好完全反应,充分反应后,称得混合物的总质量为164.6 g(忽略二氧化碳的溶解对质量的影响)。请计算:
①反应过程中产生的二氧化碳质量为 g。②该草木灰试样中碳酸钾的质量分数。
③若配制实验中所用的稀盐酸100g,需要溶质质量分数为14.6%的盐酸多少克?
[探究活动一] 根据所学酸碱盐知识,同学们猜想草木灰中含有能与酸反应产生气体的盐类物质,于是,设计并进行如下图所示的实验。观察到锥形瓶A内有大量的气泡冒出,试管B中澄清的石灰水变浑浊。

根据上述实验现象推断:产生的气体中含有 ,
试管B中有关反应的化学方程式为 。
[探究活动二]资料摘要Ⅰ:草木灰中的主要成分是碳酸钾,碳酸
钾的水溶液和碳酸钠溶液酸碱性相似。
(1)向碳酸钾的水溶液中滴入酚酞试液,溶液显 色。
(2)请你写出上述“探究活动一”中,锥形瓶A内发生的一个反应的化学方程式: 。
(3)某同学欲测定这些草木灰中碳酸钾的含量,称天平称取69g试样于烧杯中,加入100g稀盐酸恰好完全反应,充分反应后,称得混合物的总质量为164.6 g(忽略二氧化碳的溶解对质量的影响)。请计算:
①反应过程中产生的二氧化碳质量为 g。②该草木灰试样中碳酸钾的质量分数。
③若配制实验中所用的稀盐酸100g,需要溶质质量分数为14.6%的盐酸多少克?
(12分)[探究活动一]

二氧化碳(或CO2) (1分)
Ca(OH)2+CO2====CaCO3↓+H2O (2分)
[探究活动二]
(1)红 (1分)
(2)K2CO3+2HCl=2KCl+H2O+CO2↑ (2分)
(3)①4.4 g … ……… …… …(1分)
②(4分)解:设试样中K2CO3的质量为x,消耗HCl的质量为y
K2CO3+2HCl=2KCl+H2O+CO2↑
138 73 44
x y 4.4 g ……………………… ……(1分)
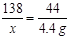 解得:x="13.8" g ………… ……(1分)
解得:x="13.8" g ………… ……(1分)
 解得:x="7.3" g ………………(1分)
解得:x="7.3" g ………………(1分)
 ……………… …(1分)
……………… …(1分)
③设需要溶质质量分数为14.6%的盐酸质量为Z
Z×14.6%==7.3g 解得: Z==50g (1分)

二氧化碳(或CO2) (1分)
Ca(OH)2+CO2====CaCO3↓+H2O (2分)
[探究活动二]
(1)红 (1分)
(2)K2CO3+2HCl=2KCl+H2O+CO2↑ (2分)
(3)①4.4 g … ……… …… …(1分)
②(4分)解:设试样中K2CO3的质量为x,消耗HCl的质量为y
K2CO3+2HCl=2KCl+H2O+CO2↑
138 73 44
x y 4.4 g ……………………… ……(1分)
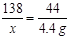 解得:x="13.8" g ………… ……(1分)
解得:x="13.8" g ………… ……(1分) 解得:x="7.3" g ………………(1分)
解得:x="7.3" g ………………(1分) ……………… …(1分)
……………… …(1分)③设需要溶质质量分数为14.6%的盐酸质量为Z
Z×14.6%==7.3g 解得: Z==50g (1分)
使澄清石灰水变浑浊的就是二氧化碳,其反应方程式为Ca(OH)2+CO2====CaCO3↓+H2O;碳酸钾的水溶液和碳酸钠溶液酸碱性相似,都显碱性,所以酚酞变红;反应过程中产生的二氧化碳质量为69+100-164.6=4.4g,然后根据4.4g二氧化碳就可以计算了。设试样中K2CO3的质量为x,消耗HCl的质量为y

K2CO3+2HCl=2KCl+H2O+CO2↑
138 73 44
x y 4.4 g ……………………… ……(1分)
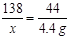 解得:x="13.8" g ………… ……(1分)
解得:x="13.8" g ………… ……(1分)
 解得:x="7.3" g ………………(1分)
解得:x="7.3" g ………………(1分)
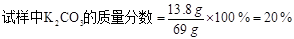 ……………… …(1分)
……………… …(1分)
③设需要溶质质量分数为14.6%的盐酸质量为Z
Z×14.6%==7.3g 解得: Z==50g (1分)

K2CO3+2HCl=2KCl+H2O+CO2↑
138 73 44
x y 4.4 g ……………………… ……(1分)
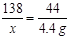 解得:x="13.8" g ………… ……(1分)
解得:x="13.8" g ………… ……(1分) 解得:x="7.3" g ………………(1分)
解得:x="7.3" g ………………(1分)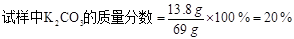 ……………… …(1分)
……………… …(1分)③设需要溶质质量分数为14.6%的盐酸质量为Z
Z×14.6%==7.3g 解得: Z==50g (1分)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目