题目内容
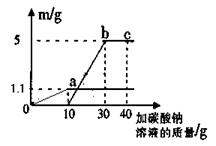
(4分)将一定量10 %的氯化钙溶液与一定量10 %的碳酸钠溶液混合,恰好完全反应,反应后过滤得难溶固体5g ,若将滤液蒸发去45g水,求所得溶液中溶质的质量分数。
10%
首先根据生成的碳酸钙的质量求出生成的溶液中氯化钠的质量,再求出碳酸钠溶液和氯化钙溶液的质量,即可求出所得溶液的质量:碳酸钠溶液的质量+氯化钙溶液的质量-碳酸钙的质量-蒸发掉得水的质量;则:
设生成的氯化钠的质量为x,参与反应的碳酸钠溶液和氯化钙溶液的质量为y、z,.

111 106 117 100
z×10% y×10% x 10g
 x=5.85g
x=5.85g y=53g
y=53g z=55.5g
z=55.5g则所得溶液中溶质的质量分数为:
 ×100%=10%
×100%=10%
练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目