题目内容
【题目】现在多数家庭使用天然气或液化石油气。液化石油气主要成分是丙烷和丁烷。已知:无水硫酸铜CuSO4遇到水由白色变为蓝色,常用于检验水的存在;浓硫酸具有强吸水性;氢氧化钠溶液能吸收二氧化碳。
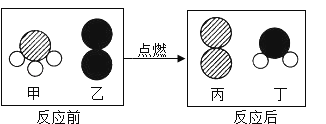
(1)写化学式:甲烷CH4、乙烷C2H6、丙烷C3H8、丁烷_____、戊烷C5H12
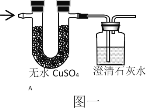
(2)写出丙烷C3H8完全燃烧的化学方程式_____;将丙烷C3H8完全燃烧产物通入“图一”装置,则无水硫酸铜由白色变为____色,澄清石灰水变浑浊的化学反应方程式_____。
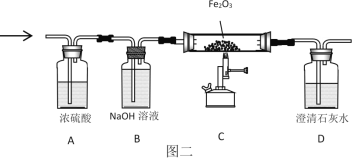
(3)将13.2g丙烷C3H8与38.4g氧气O2充分反应后生成物依次通过“图二”装置;认真阅读下表,回答相关问题:
物质 质量 /g | 丙烷C3H8 | 氧气O2 | 装置A | 装置B | X |
反应前 | 13.2 | 38.4 | 508.2 | 485.4 | 0 |
反应后 | 0 | 0 | 529.8 | 498.6 | a |
①a=_____;求物质X的化学式(写出计算过程)
②写出13.2g丙烷C3H8与38.4g氧气O2充分反应的化学方程式_____。
③装置C中的现象是_____;化学反应方程式是_____。由上可知“图三”装置有一处明显不足_____。
④判断CO2是否被装置B完全吸收的方法:在装置B、C之间增加装有澄清石灰水的洗气瓶,若澄清石灰水_____,则CO2被完全吸收。
⑤若增加氧气的量,则X与H2O的化学计量数之比将_____(填“变大”、“不变”或“变小”)。
【答案】C4H10 C3H8+5O2![]() 3CO2+4H2O 蓝 CO2+Ca(OH)2=CaCO3↓+H2O 16.8 C3H8+4O2
3CO2+4H2O 蓝 CO2+Ca(OH)2=CaCO3↓+H2O 16.8 C3H8+4O2![]() CO2+4H2O +2CO 红棕色固体变为黑色 Fe2O3+3CO
CO2+4H2O +2CO 红棕色固体变为黑色 Fe2O3+3CO![]() 2Fe+3CO2 没有尾气处理 不变浑浊 变小
2Fe+3CO2 没有尾气处理 不变浑浊 变小
【解析】
(1)从所给出的信息可知,随着碳原子的增加,物质的名称逐次增加;其中当碳原子=n,则氢原子=2n+2,那么丁烷,其中碳原子=4,则氢原子=10,故化学式C4H10;
(2)丙烷C3H8完全燃烧生成二氧化碳和水,反应的化学方程式为:C3H8+5O2![]() 3CO2+4H2O;无水硫酸铜遇到水由白色变为蓝色;澄清石灰水变浑浊的化学反应方程式为:CO2+Ca(OH)2 =CaCO3↓+H2O;
3CO2+4H2O;无水硫酸铜遇到水由白色变为蓝色;澄清石灰水变浑浊的化学反应方程式为:CO2+Ca(OH)2 =CaCO3↓+H2O;
(3)①根据质量守恒定律可得:a=13.2g+38.4g+508.2g+485.4g-529.8g-498.6g=16.8g;根据实验可知,装置A增加的质量=5289.5g-508.2g=21.6g是丙烷燃烧生成水的质量,装置B增加的质量=498.6g-485.4g=13.2g是丙烷燃烧生成二氧化碳的质量;则:X中碳元素的质量=13.2g![]()
![]() -13.2g
-13.2g![]()
![]() =7.2g,氧元素的质量=38.4g-21.6g
=7.2g,氧元素的质量=38.4g-21.6g![]()
![]() -13.2g
-13.2g![]()
![]() =9.6g,所以,X中碳和氧的原子个数比=
=9.6g,所以,X中碳和氧的原子个数比=![]() :
:![]() =1:1,故X化学式为CO;
=1:1,故X化学式为CO;
②13.2g丙烷C3H8与38.4g氧气O2充分反应生成二氧化碳、一氧化碳和水,反应的化学方程式为:C3H8+4O2![]() CO2+4H2O +2CO;
CO2+4H2O +2CO;
③一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,装置C中的现象是红棕色固体变为黑色;反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
④二氧化碳能使澄清石灰水变浑浊,在装置B、C之间增加装有澄清石灰水的洗气瓶,若澄清石灰水不变浑浊,则CO2被完全吸收;
⑤氧气的量越大,丙烷燃烧越充分,生成的一氧化碳会越少,而生成水的质量不变,所以一氧化碳与水的化学计量数之比越小。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
剩余固体质量/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0至t1时间段,固体质量不变的原因是____________________________。
(2)反应中产生氧气的质量是_________。
(3)求样品中高锰酸钾的质量分数_________。
(4)该反应中转化为氧气的氧元素质量占高锰酸钾中氧元素质量的________%。