题目内容
【题目】石灰石的主要成分是碳酸钙,煅烧石灰石时,其中的碳酸钙会分解生成氧化钙和二氧化碳(杂质不反应)。充分煅烧12.5g石灰石样品,反应完后称得剩余固体质量为8.1g。计算
(1)反应完全后固体减少了_________g,这是生成___________(填化学式)的质量。
(2)石灰石样品中碳酸钙的质量分数是多少________(写出计算过程)。
【答案】4.4 CO2 80%(详见解析过程)
【解析】
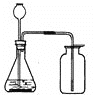
(1)根据质量守恒定律可知,生成二氧化碳的质量为:12.5g-8.1g=4.4g;根据化学方程式CaCO3![]() CaO+CO2↑可知,这是生成CO2的质量;
CaO+CO2↑可知,这是生成CO2的质量;
(2)设:生4.4g的二氧化碳需碳酸钙的质量为x。

![]() x=10g
x=10g
石灰石样品中碳酸钙的质量分数=![]() 。
。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案【题目】现在多数家庭使用天然气或液化石油气。液化石油气主要成分是丙烷和丁烷。已知:无水硫酸铜CuSO4遇到水由白色变为蓝色,常用于检验水的存在;浓硫酸具有强吸水性;氢氧化钠溶液能吸收二氧化碳。
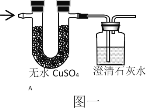
(1)写化学式:甲烷CH4、乙烷C2H6、丙烷C3H8、丁烷_____、戊烷C5H12
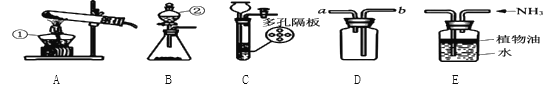
(2)写出丙烷C3H8完全燃烧的化学方程式_____;将丙烷C3H8完全燃烧产物通入“图一”装置,则无水硫酸铜由白色变为____色,澄清石灰水变浑浊的化学反应方程式_____。
(3)将13.2g丙烷C3H8与38.4g氧气O2充分反应后生成物依次通过“图二”装置;认真阅读下表,回答相关问题:
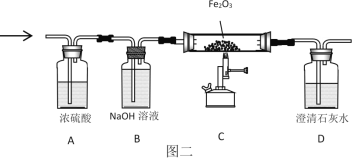
物质 质量 /g | 丙烷C3H8 | 氧气O2 | 装置A | 装置B | X |
反应前 | 13.2 | 38.4 | 508.2 | 485.4 | 0 |
反应后 | 0 | 0 | 529.8 | 498.6 | a |
①a=_____;求物质X的化学式(写出计算过程)
②写出13.2g丙烷C3H8与38.4g氧气O2充分反应的化学方程式_____。
③装置C中的现象是_____;化学反应方程式是_____。由上可知“图三”装置有一处明显不足_____。
④判断CO2是否被装置B完全吸收的方法:在装置B、C之间增加装有澄清石灰水的洗气瓶,若澄清石灰水_____,则CO2被完全吸收。
⑤若增加氧气的量,则X与H2O的化学计量数之比将_____(填“变大”、“不变”或“变小”)。