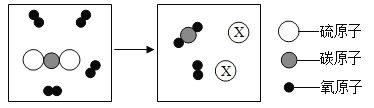
题目内容
【题目】某化学兴趣小组测定某工业废水(含有HCl、HNO3等可溶性杂质)中HCl的含量。取10g废水于烧杯中,加入100gAgNO3溶液,恰好完全反应,经过滤得到185.65g溶液。(其他杂质不参加反应,过滤后滤液的损失忽略不计。)
(1)充分反应后生成沉淀的质量为__________g
(2)该工业废水中HCl的质量分数为多少__________?(写出计算过程)
【答案】14.35 3.65%
【解析】
硫酸与氯化钡反应生成了硫酸钡沉淀和盐酸,据质量守恒定律求出生成沉淀的质量,根据化学方程式由沉淀的质量可以计算出废水中硫酸的质量;再根据溶质的质量分数计算出该工业度水中硫酸的质量分数。
解:(1)由质量守恒定律可知生成的氯化银的质量为:100g+100g-185.65g=14.35g,设参加反应HCl的质量为x,
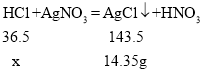
![]()
x=3.65g;
(2)该工业废水中HCl的质量分数为:![]() ×100%=3.65%。
×100%=3.65%。

【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后__和__不变。
(实验)用天平称量0.2g氧化铜,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
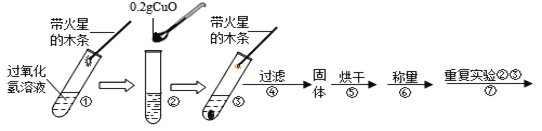
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
____,带火星的木条复燃 | 所得固体____g | 溶液中有气泡放出,__________ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)过氧化氢能被氧化铜催化分解放出氧气的化学反应的符号表达式为__________
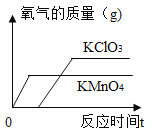
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
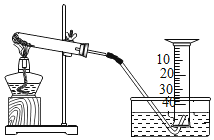
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是___________________
(2)表中所列3种催化剂的催化效果最佳的是______________
(3)写出KClO3分解的化学方程式:_________________________
(4)由实验1和实验4可知,KCl____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____________
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内____________