题目内容
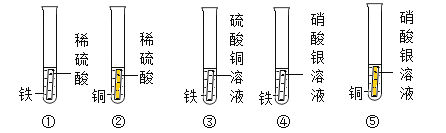
【题目】在学习酸的化学性质后,同学们做了如图所示的A、B两个实验:
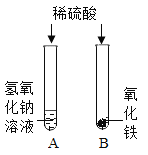
(1)A试管中发生反应的化学方程_________________。向B试管中加入一定量的稀硫酸后,观察到氧化铁全部消失。
(2)实验结束后,小红将A、B两试管中的废液倒入同一洁净的烧杯中,片刻后发现烧杯中出现了红褐色沉淀,经分析,红褐色沉淀是氢氧化铁。
小红将烧杯中物质进行过滤得到无色滤液,滤液中含有什么溶质?小红、小军对此进行探究。
(实验讨论)
①小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,因为_____________。
②小军认为滤液中不可能有Fe2(SO4)3,理由是_________。
(提出猜想)
猜想Ⅰ:Na2SO4、NaOH
猜想Ⅱ:_________
实验操作 | 实验现象 | 结论 |
取少量滤液于试管中,向其中滴加_________ | _________ | 猜想Ⅰ成立 |
【答案】2NaOH+H2SO4═Na2SO4+2H2O 烧杯中生成的氢氧化铁沉淀不能与稀硫酸共存 过滤得到无色滤液,而Fe2(SO4)3溶液是黄色溶液 Na2SO4 酚酞试液 变红色
【解析】
(1)A试管中稀硫酸和氢氧化钠反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O;
[实验讨论]①小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,这是因为烧杯中生成的氢氧化铁沉淀不能与稀硫酸共存;
②小军认为滤液中不可能有Fe2(SO4)3,理由是过滤得到无色滤液,而Fe2(SO4)3溶液是黄色溶液;
[提出猜想]由猜想Ⅰ:Na2SO4、NaOH可知,猜想Ⅱ是Na2SO4;
[设计实验]取少量滤液于试管中,向其中滴加酚酞试液,滤液变红色,说明滤液中含有氢氧化钠。

 阅读快车系列答案
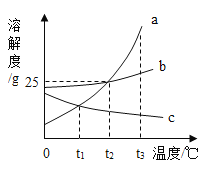
阅读快车系列答案【题目】根据下表回答问题:
温度/℃ | 20 | 40 | 60 | |
溶解度 | NaCl | 36.0 | 36.6 | 37.3 |
| 31.6 | 63.9 | 110 | |
(1)60℃,100g水中最多能溶解![]() 的质量为__________。
的质量为__________。
(2)下列说法正确的是_________(填序号)。
A.20℃时,![]() 饱和溶液的质量分数为31.6%
饱和溶液的质量分数为31.6%
B.40℃时,136.6gNaCl溶液中一定含有36.6gNaCl
C.将40℃时![]() 的饱和溶液降温到20℃,析出32.3g
的饱和溶液降温到20℃,析出32.3g![]() 固体
固体
D.将40℃时NaCl和![]() 的饱和溶液分别降温至20℃,降温后两溶液质量分数的大小关系为NaCl>
的饱和溶液分别降温至20℃,降温后两溶液质量分数的大小关系为NaCl>![]()
(3)20℃时,按下列图示操作:

①在溶液A、B、C中,![]() 溶解达到饱和状态的有_______(填字母)。
溶解达到饱和状态的有_______(填字母)。
②比较溶液A、B中![]() 的质量分数:A_______B(填“>“或” <”或“=”)。
的质量分数:A_______B(填“>“或” <”或“=”)。