题目内容
【题目】蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸由_____种元素组成。
(2)丙氨酸分子中C、H、O、N各原子个数比为_____。
(3)丙氨酸中C、H、O、N元素的质量比为_____。
(4)酸的相对分子质量是_____。
(5)丙氨酸中氧元素的质量分数为 _____。
(6)89克丙氨酸中氧元素的质量为_____。
【答案】4 3:7:2:1 36:7:32:14 89 35.96% 32g
【解析】
(1)丙氨酸是由碳、氢、氧、氮四种元素组成的.故填:4;
(2)丙氨酸分子中C、H、O、N原子个数比=3:7:2:1;故填:3:7:2:1;
(3)丙氨酸分子中C、H、O、N各元素质量比为(12×3):(1×7):(16×2):14=36:7:32:14.故填:36:7:32:14;
(4)丙氨酸的相对分子质量为:12×3+1×7+16×2+14=89.故填:89;
(5)丙氨酸中氧元素的质量分数为:![]() ×100%≈35.96%;故填:35.96%;
×100%≈35.96%;故填:35.96%;
(6)89g丙氨酸中氧元素的质量是89g×![]() ×100%=32g;故填:32g.
×100%=32g;故填:32g.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】在学习酸的化学性质后,同学们做了如图所示的A、B两个实验:
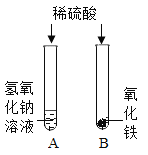
(1)A试管中发生反应的化学方程_________________。向B试管中加入一定量的稀硫酸后,观察到氧化铁全部消失。
(2)实验结束后,小红将A、B两试管中的废液倒入同一洁净的烧杯中,片刻后发现烧杯中出现了红褐色沉淀,经分析,红褐色沉淀是氢氧化铁。
小红将烧杯中物质进行过滤得到无色滤液,滤液中含有什么溶质?小红、小军对此进行探究。
(实验讨论)
①小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,因为_____________。
②小军认为滤液中不可能有Fe2(SO4)3,理由是_________。
(提出猜想)
猜想Ⅰ:Na2SO4、NaOH
猜想Ⅱ:_________
实验操作 | 实验现象 | 结论 |
取少量滤液于试管中,向其中滴加_________ | _________ | 猜想Ⅰ成立 |
【题目】下表是元素周期表的一部分:
族 周期 | IA | 0 | ||||||
一 | 1 H 1.008 | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He 4.003 |
二 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
三 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)12号元素的元素符号为_____;Cl元素的相对原子质量为_____。
(2)Ne的化学性质_____;F元素原子最外层电子数为_____。
(3)表中不同种元素最本质的区别是_____(填字母)。
A 质子数不同 B 相对原子质量不同 C 中子数不同
(4)根据如图回答问题:

①在化学反应中溴原子_____(填 “易得”或“易失”)电子。
②溴在元素周期表中处于第_____ 周期。其中子数和质子数之差约为_____。