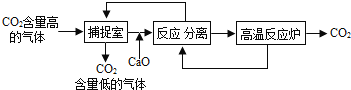
题目内容
【题目】某工厂将生产过程中产生的含铜废料进行回收并合理应用:
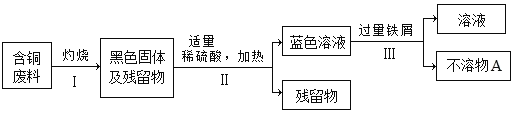
(1)将步骤Ⅱ反应的化学方程式补充完整:_____
(2)古代“湿法冶金”的原理与图中步骤_____(填“Ⅰ”、“Ⅱ”或“Ⅲ”)的反应原理相同。
(3)利用化学方法从“不溶物A”中提纯铜单质:_____(用化学方程式表示)。
【答案】CuO+H2SO4![]() CuSO4+H2O Ⅲ Fe+H2SO4═FeSO4+H2↑
CuSO4+H2O Ⅲ Fe+H2SO4═FeSO4+H2↑
【解析】
含铜废料灼烧会生成氧化铜,故黑色固体是氧化铜的混合物,加稀硫酸后可以和氧化铜生成蓝色硫酸铜溶液,硫酸铜加过量铁屑发生反应:![]() ,得到Fe和Cu的混合物A。
,得到Fe和Cu的混合物A。
(1)铜灼烧生成黑色氧化铜,氧化铜和稀硫酸反应生成氧化铜和水,化学方程式为:CuO+H2SO4![]() CuSO4+H2O,故填:CuO+H2SO4
CuSO4+H2O,故填:CuO+H2SO4![]() CuSO4+H2O;
CuSO4+H2O;
(2)古代“湿法冶金”的原理是用硫酸铜和铁发生反应生成铁和铜,和步骤Ⅲ原理相同,故填:Ⅲ;
(3)利用化学方法从“不溶物A”中提纯铜单质就是去除混合物中过量的铁粉,可以加稀硫酸发生反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4═FeSO4+H2↑;

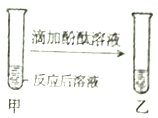
【题目】小明在做“盐酸中和氢氧化钠”的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是小明对反应后溶液的酸碱性进行了探究。
【探究目的】确定反应后溶液的酸碱性
【猜想与假设】反应后溶液呈碱性,也可能呈_____,也可能呈_____。
【实验验证】
实验操作 | 实验现象 | 实验结论 |
| 无色酚酞溶液______ | 溶液呈碱性,使其呈碱性的微粒是_____ |
无色酚酞溶液不变色 | 溶液呈______ |
【继续验证】
实验操作 | 实验现象 | 实验结论 |
| 粉末部分或全部消失.溶液变为黄色 | 溶液呈_____,反应的化学方程式是_____ |
____________ | 溶液呈______ |
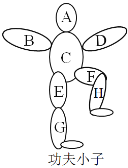
【题目】如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
甲 | 乙 | 丙 | 丁 | 戊 | |
A | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
B | 硝酸银 | 铁 | 稀盐酸 | 氢氧化钡 | 碳酸钙 |
C | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
D | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
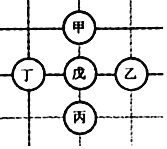
A. A B. B C. C D. D
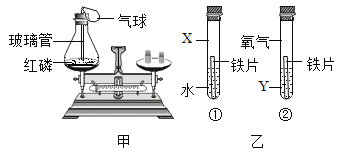
【题目】在学习酸的化学性质后,同学们做了如图所示的A、B两个实验:
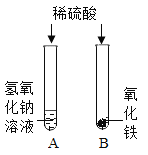
(1)A试管中发生反应的化学方程_________________。向B试管中加入一定量的稀硫酸后,观察到氧化铁全部消失。
(2)实验结束后,小红将A、B两试管中的废液倒入同一洁净的烧杯中,片刻后发现烧杯中出现了红褐色沉淀,经分析,红褐色沉淀是氢氧化铁。
小红将烧杯中物质进行过滤得到无色滤液,滤液中含有什么溶质?小红、小军对此进行探究。
(实验讨论)
①小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,因为_____________。
②小军认为滤液中不可能有Fe2(SO4)3,理由是_________。
(提出猜想)
猜想Ⅰ:Na2SO4、NaOH
猜想Ⅱ:_________
实验操作 | 实验现象 | 结论 |
取少量滤液于试管中,向其中滴加_________ | _________ | 猜想Ⅰ成立 |