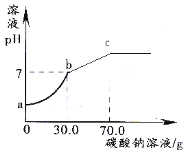
题目内容
【题目】(10分)如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.
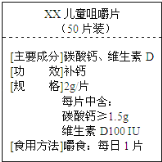
该钙片主要成分碳酸钙,碳酸钙的相对分子质量为 ① .
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一:甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体的量来进行计算.
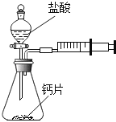
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为 .
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.
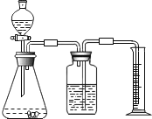
(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会 ① (填偏大或偏小),你认为他们的理由是 ② ,你的改进方案是 ③ ;广口瓶内原有的空气对实验结果 ④ (填“有”或“没有”)影响.
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是 .
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下实验步骤.
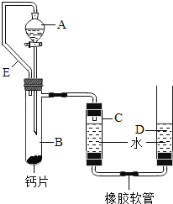
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是: ;
(2)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管, ,则气密性良好;
(3)实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是 (填“真实”或“不真实”)的.(最后一空不需要写计算过程)
【答案】①100 .方案一:(1)样品过多产生气体过多会导致注射器活塞被顶出;取样过少产生气体太少无法测量体积。(合理均可) 方案二:(1)①偏小 (填偏大或偏小);②理由是会有部分二氧化碳溶解在水中,③改进方案是在水面上滴一层植物油 ;④没有 (2)滴入的盐酸有一定的体积,导致生成的气体体积偏大.方案三:(1)使样品中的碳酸钙完全反应 ;(2)液面静止后,C、D液面仍存在高度差,则气密性良好;(3)真实
【解析】
试题分析:根据碳酸钙的化学式CaCO3确定含三种元素,碳酸钙的相对分子质量为:40+12+16×3=100;方案一:由图示知通过注射器最后的数据确定,样品取用过多,反应产生的气体多,会导致注射活塞被顶出;取用样品过少,反应产生的气体太少,无法测量.方案二:(1)二氧化碳能溶于水,改进方案是在水面上滴一层植物油;广口瓶内原有的空气对实验结果没有影响;(2)盐酸易挥发出氯化氢气体,故,滴入的盐酸挥发出氯化氢气体,导致生成的气体体积偏大.方案三:(1)钙片磨碎后增大了与酸的接触面积,使反应更完全充分;(2)装置气密性良好的话在C、D两管中装好水且液面相平,提高D管静止一段时间后CD液面仍存在高度差证明气密性良好;(3)【实验结论】:若十片含碳元素质量为1.5×10×3/25=1.8g,生成二氧化碳质量为1.8÷12/44=6.6g<6.82g,故选择:真实.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案