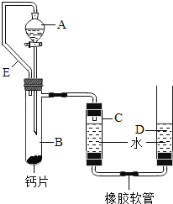
题目内容
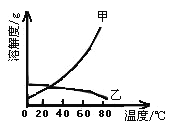
【题目】取盐酸溶液60.0g,滴加质量分数26.5%的Na2C03溶液(见下图),溶液pH的变化如右图所示
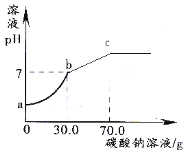
(1)则与盐酸恰好完全反应时碳酸钠溶液的质量为 g;
(2)请计算该盐酸溶液恰好完全反应后溶液中的溶质质量分数(写出计算过程,精确到0.1%)。
【答案】(1)30.0克 (2)10.1%
【解析】
试题分析:(1)根据图像可知,a→b表示随着碳酸钠的加入,发生反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,故盐酸不断被消耗,PH不断增大,当PH等于7时,表示两者恰好完全反应,而b→c则表示所加的碳酸钠过量,故与盐酸恰好完全反应时碳酸钠溶液的质量为30.0克
(2)根据化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2、NaCl的质量关系,可分别求出CO2、NaCl的质量,进一步计算该盐酸溶液恰好完全反应后溶液中的溶质质量分数
解:设完全反应生成的二氧化碳为x,生成的氯化钠为Y
2HCI + Na2CO3 ===== CO2↑ + 2NaCl + H2O-
106 44 117
30g×26.5% x y
106:44 == 30g×26.5% :x x=3.3g
106:117 == 30g×26.5% :y y=8.8g
故反应后溶液质量=60g+30g-3.3g=86.7g
反应后溶液中的溶质质量=8.8g/86.7g×100% ==10.1%
答:(略)

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目