题目内容
【题目】(10分)我国著名化学家侯德榜发明的“联合制碱法”主要原理是:I.向浓氨水中通入足量的CO2,使氨气、水和CO2发生化合反应而生成NH4HCO3溶液;II.向所得溶液中加入食盐细粒,充分搅拌,会析出溶解度较小的小苏打固体并得到化肥溶液;III.加热析出的固体制取纯碱。此法经过调整并应用于化工产业,某化工企业的工艺流程示意图如下:
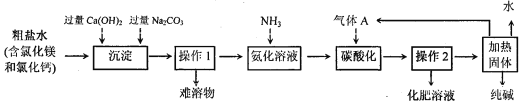
请完成下列填空:
(1)“联合制碱原理II”中发生反应的化学方程式为 。
(2)在如图的流程中,先加Ca(OH)2溶液的目的是 ,再加入Na2CO3溶液的目的是 。
(3)“操作1”的名称是 ,“氨化溶液”后,溶液的pH 7(填:“大于”、“小于”或“等于”),从而有利于吸收“气体A”,气体A为 (填名称)。
(4)利用“270℃以上小苏打完全分解,纯碱受热不分解”的性质,化学兴趣小组的同学对实验室所购纯碱(假设所含杂质均为小苏打)进行了如下实验:称取20.00g干燥的固体样品放入坩埚,300℃恒温加热至质量不变,在干燥器中冷却后称量残留固体质量为19.38g。
根据题目所给信息,计算该样品中纯碱的质量分数(写出计算过程)。
【答案】(1)NH4HCO3+NaCl===NH4Cl +NaHCO3↓
(2)除去氯化镁;将多余的氢氧化钙和氯化钙除去;
(3)过滤;大于;二氧化碳;(4)91.6%
【解析】
试题分析:(1)根据题意知,化学方程式为:NH4HCO3+NaCl===NH4Cl +NaHCO3↓(2)氢氧化钙能与氯化镁反应,生成氢氧化镁沉淀,从而除去氯化镁;碳酸钠能与多余的氢氧化钙反应,也能与氯化钙反应,从而将氯化钙和多余的氢氧化钙除去;(3)将沉淀与溶液分离可采用过滤;氨气溶于水呈碱性,pH大于7;气体A为二氧化碳;((4)减少固体质量即为碳酸氢钠受热分解产生二氧化碳质量,利用化学方程式进行计算即可。具体步骤如下:
解:设样品中碳酸氢钠质量为X
根据题意知,生成二氧化碳和水的总质量=20.00g-19.38g=0.62g
2NaHCO3![]() Na2CO3+ H2O+ CO2↑
Na2CO3+ H2O+ CO2↑
168 62
X 0.62g
168/44=X/ 0.62g X=1.68g
则纯碱质量=20.00g-1.68g=18.32g
所以样品中纯碱的质量分数=18.32g/20.00g×100%=91.6%
答:略