��Ŀ����
����Ŀ������ͼʾ�ش�������⡣
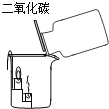
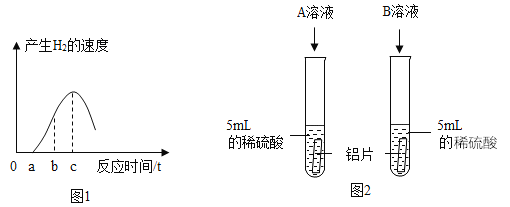
(1)����ͨ������ʵ��̽��Ӱ������������ء�
ʵ�� | ���� |
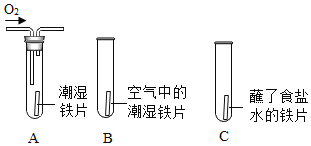
| һ��ʱ�����A��C ����Ƭ��죬B����Ƭ��Ȼ����,�Ա�A��B�е�����˵�����������������һ����Ҫ������___________���Ա�B��C�е�����˵�������������____________�йء� |
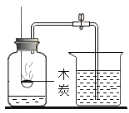
(2)С��ͬѧ����������ַ��������������ƺ������������ֱ�����Һ��
ʵ��һ | ʵ��� | ���� |
|
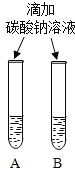
| ���ַ����о��۲쵽B�Թ��ڳ��ְ�ɫ���ǣ���B����ҺΪ______(������) ��ʵ��������ԭ����_____________�� |
���𰸡�����Ũ�� �Ȼ���(��ʳ�λ� NaCl) ��������������Һ �������Ƶ��ܽ�����¶����߶���С
��������
��1��һ��ʱ�����A��C ����Ƭ��죬B����Ƭ��Ȼ����,�Ա�A��B�е�����˵�����������������һ����Ҫ����������Ũ�ȣ�����Ũ��Խ��ʪ����ƬԽ�������⣻�Ա�B��C�е�����˵�������������ʳ���йأ�ʳ��ˮ�����˵����ԣ�ʹ��Ƭ���������⡣
��2�����ַ����о��۲쵽B�Թ��ڳ��ְ�ɫ���ǣ���B����ҺΪ��������������Һ����Ϊ������������̼���Ʒ�Ӧ����̼��ư�ɫ���� ��ʵ��������ԭ���ǣ��������Ƶ��ܽ�����¶����߶���С��������Һ����ʱ���������ƹ���������

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�����Ŀ��Mg(OH)2���й㷺��Ӧ��,������þ���Ʊ����о���Ա��һ����������þ����м��������ϡ����,����ܽ����ӡ�����,�õ�ֻ��MgSO4��H2SO4�Ļ����Һ��Ϊȷ�������Һ��þ�ĺ���,ȡ4�ݻ����Һ��100g,��ÿ�ݻ����Һ�м���һ��������4%NaOH��Һ,�õ�ʵ���������±���ʾ:
ʵ���� | �� | �� | �� | �� |
NaOH��Һ����/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2����/g | 0.232 | 0.522 | 0.580 | 0.580 |
��1��ʵ�� ����ʵ���ţ�������þ��ȫ��Ӧ;
��2������100g�����Һ�к�MgԪ�ص�������д��������̣�;
��3��������0.580g����ʱ����4%NaOH��Һ��������д��������̣�
����Ŀ������ʵ������ܴﵽĿ�ĵ��ǣ�������
A | B | C | D |
|
|
|
|
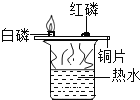
֤��������̼����ȼ������ȼ���ܶȴ��ڿ��� | �ⶨ�����������ĺ��� | ֤����ȼ��ȼ����Ҫ�������¶ȴﵽ�Ż�� | ֤����������ˮ��������ͬ���õĽ�� |
A.AB.BC.CD.D
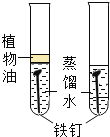
����Ŀ��Ϊ̽��̼��ԭ����ͭ�����ʵ��������ȡľ̿�ۺ�����ͭ�ĸ�������1-2.5g����ͼ��ʾװ�ý���ʵ�顣
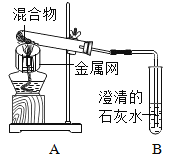
(1)ľ̿��ԭ����ͭ�Ļ�ѧ����ʽΪ__��ʵ�������Aװ�����Թ��ڲ�����������__��
(2)�ƾ��ƻ���ӽ������ֵ�Ŀ����____��
���������ϣ�������ͭ(CuO)Ϊ��ɫ���塣��̼��ԭ����ͭ�õ���ͭ�п��ܺ���������������ͭ��������ͭΪ��ɫ���壬����ϡ���ᷴӦ��Cu2O+H2SO4=CuSO4+H2O+Cu
���������飩ȡһ�����Ļ�������ͼ��ʾװ�ý���ʵ�顣
��� | ľ̿��������ͭ�������� | ��Ӧ�����ʵ���ɫ��״̬ | |
1 | 1��9 | ��ɫ�����н������� | ����������ɫ���� |
2 | 1��10 | ���к�������ɫ���� | |
3 | 1��11 | ���м�������ɫ���� | |
4 | 1��12 | ��ɫ���� | |
5 | 1��13 | ���н϶��ɫ���� | |
����������ͣ�(3)������ʵ����Եõ��Ľ�����___��������ѡ�
����˼�����ۣ�
(4)Ϊ�˼������ɵĺ�ɫ�������Ƿ���Cu2O�������Լ���____��
(5)��װ����̲��е�װ����������Ľ���ʵ�����ʱ�������õ��ɼмн���Ƥ�ܣ���Ϩ��ƾ��ƣ���������Ŀ�ij��˷�ֹʯ��ˮ�������ȵ��Թܣ�ʹ�Թ�ը���⣬�����Է�ֹ____��