题目内容
【题目】通过学习,我们已经了解了常见金属在溶液中的活动性顺序。铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、Al、Cu的金属活动性顺序进行探究,过程如下:
(提出假设)
(1)对三种金属的活动性顺序提出三种可能的假设:
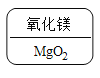
a.Al>Cr>Cu b.Cr>Al>Cu c.________________
(查阅资料)该研究小组必须查阅的资料是_________(填序号)
①Cr、Al、Cu三种金属的密度②Cr能否与酸反应③Cr、Al、Cu三种金属导电性
(设计实验)
同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如表:
金属 | Cr | Al | Cu |
与盐酸反应现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
(控制实验条件)
(2)打磨三种金属的目的____________;上述实验使用等浓度的盐酸溶液的理由是___________________。
(得出结论)
(3)原假设中正确的是_______(填假设中“a”“b”或“c”).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式:___________。
(结论应用)
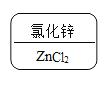
(4)根据探究结果,写出Al丝与CuSO4溶液反应的化学方程式_______________,并写出反应的实验现象___________________。
【答案】Al>Cu>Cr ② 除去金属表面的金属氧化膜 盐酸浓度不同,会影响产生气体的速率 a ![]()
![]() 有红色固体析出,溶液由蓝色变为无色
有红色固体析出,溶液由蓝色变为无色
【解析】
提出假设:在金属活动性顺序里,铝位于铜之前,结合其它两个假设,故假设c为:Al>Cu>Cr;
查阅资料:验证金属的活动性顺序,可通过金属与酸或盐溶液反应,故该小组必须查阅的资料是Cr能否与酸反应。
故选②;
设计实验:(2)打磨金属的目的是除去金属表面的金属氧化膜,防止其影响实验的进行,故填:除去金属表面的金属氧化膜;
盐酸浓度不同,会影响产生气体的速率,影响实验结果的验证,故应选用相同浓度的盐酸溶液,故填:盐酸浓度不同,会影响产生气体的速率;
得出结论:(3)同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,Cr与盐酸反应,气泡产生缓慢,金属逐渐溶解,铝与盐酸反应气泡产生激烈,金属迅速溶解,铜与盐酸不反应,反应越剧烈,金属的活动性越强,故三种金属的活动性顺序为:Al>Cr>Cu,故原假设中正确的是a;
铬与盐酸反应生成氯化铬和氢气,该反应的化学方程式为:![]() ;
;
结论应用:(4)铝与硫酸铜反应生成硫酸铝和铜,该反应的化学方程式为:![]() ,实验现象为:有红色固体析出,溶液由蓝色变为无色。
,实验现象为:有红色固体析出,溶液由蓝色变为无色。

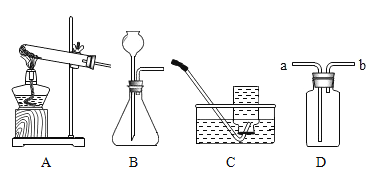
【题目】为探究碳还原氧化铜的最佳实验条件,取木炭粉和氧化铜的干燥混合物1-2.5g用如图所示装置进行实验。
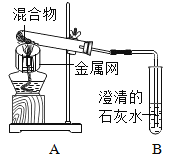
(1)木炭还原氧化铜的化学方程式为__。实验过程中A装置中试管内产生的现象是__。
(2)酒精灯火焰加金属网罩的目的是____。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+H2O+Cu
(进行试验)取一定量的混合物,用上图所示装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有较多黑色物质 | |
(结论与解释)(3)由上述实验可以得到的结论是___,条件最佳。
(反思与评价)
(4)为了检验生成的红色固体中是否含有Cu2O,所需试剂是____。
(5)该装置与教材中的装置相比略作改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止____。
【题目】关于下列事实的解释不正确的是( )
选项 | 事实 | 解释 |
A | 10mL酒精和10mL水混合后体积小于20mL | 分子之间有间隔 |
B | 稀硫酸和稀盐酸化学性质相似也存在差异 | 溶液中都含有H+ , 也存在不同的SO42-、Cl-离子 |
C | 酒精溶液不导电 | 溶液中没有自由移动的带电粒子 |
D | 化肥硫酸铵不能和熟石灰混放或混用 | 硫酸铵与熟石灰发生中和反应 |
A.A B.B C.C D.D