题目内容
【题目】高铁酸钾(K2FeO4)是一种集吸附、凝聚、杀菌等功能为一体的新型高效水处理剂,可将水中的三氯乙烯(C2HCl3)除去85.6%,下列说法正确的是
A.高铁酸钾中铁元素的化合价为+3价
B.高铁酸钾中含有两种金属单质
C.三氯乙烯中碳元素的质量分数约为18.25%
D.三氯乙烯是由2个碳原子、1个氢原子和3个氯原子构成的
【答案】C
【解析】
A、根据化合物中各元素正负化合价的代数和为零,设铁元素的化合价为x,则有(+1)×2+x+(-2)×4=0,解得x=+6,故错误;
B、高铁酸钾是纯净物,K2FeO4中含有钾、铁两种金属元素,故错误;
C、三氯乙烯中碳元素的质量分数为![]() ×100%≈18.25%,故正确
×100%≈18.25%,故正确
D、C2HCl3是由分子构成的,而不是由原子直接构成的,故错误。
故选C。

【题目】2019 年 3 月 22 日是第二十七届“世界水日”。
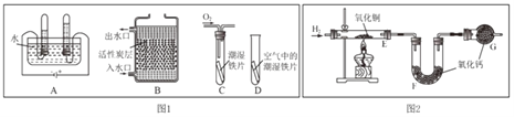
(1)根据图 1 回答下列问题。
①A 图所示的是电解水实验,写出该反应的化学方程式______;
②B 图所示的是活性炭净水器的示意图,其中活性炭的作用是______。
③C、D 图所示的是探究铁生锈条件的实验,一段时间后发现 C 中铁片变红,D 中铁片依 然光亮,对比 C、D 中的现象,说明影响铁生锈快慢的一个重要因素是______。
(2)若用质量分数为 10%的氢氧化钠溶液(密度为 1.1g/cm3)配制 220g 质量分数为 5%的 氢氧化钠溶液。
①需要 10%的氢氧化钠溶液体积为______mL。
②实验室配制该溶液的主要步骤有:计算、量取、______、装瓶并贴上标签。
③若量取氢氧化钠溶液读数时仰视,而其余操作均正确,这样配得的溶液的溶质质量分数 会______(填“偏高”、“偏低”或“无影响”)。
(3)根据上图 2 实验装置测定水的组成。 反应前后测得的 E、F 装置质量数据见表。
装置 E | 装置 F | |
反应前的质量/g | 38.2 | 212.4 |
反应后的质量/g | a | 214.2 |
①若测定水中氢、氧元素的质量比符合理论值,则表中 a 的数值是______。
②下列因素中,对测定结果有影响的是______(填字母)。
ACuO 粉末不干燥 BCuO 没有完全转化为 Cu C没有 G 装置
【题目】Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液。为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
(1)实验 (填实验编号)中硫酸镁完全反应;
(2)计算100g混合溶液中含Mg元素的质量(写出计算过程);
(3)求生成0.580g沉淀时加入4%NaOH溶液的质量(写出计算过程)
【题目】为探究碳还原氧化铜的最佳实验条件,取木炭粉和氧化铜的干燥混合物1-2.5g用如图所示装置进行实验。
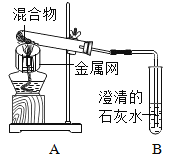
(1)木炭还原氧化铜的化学方程式为__。实验过程中A装置中试管内产生的现象是__。
(2)酒精灯火焰加金属网罩的目的是____。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+H2O+Cu
(进行试验)取一定量的混合物,用上图所示装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有较多黑色物质 | |
(结论与解释)(3)由上述实验可以得到的结论是___,条件最佳。
(反思与评价)
(4)为了检验生成的红色固体中是否含有Cu2O,所需试剂是____。
(5)该装置与教材中的装置相比略作改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止____。