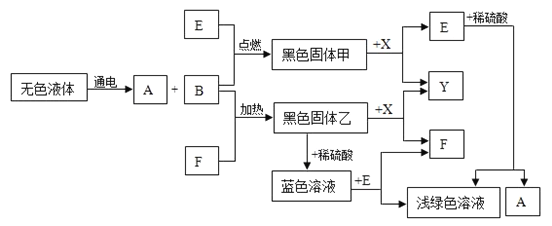
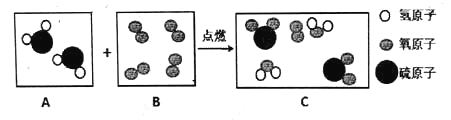
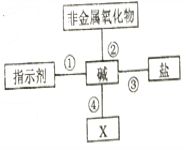
题目内容
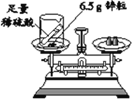
【题目】实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有50g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到0.8g气体。请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为__g.
(2)计算原过氧化氢溶液中溶质的质量分数为_____.
【答案】 2.5 3.4%
【解析】(1)二氧化锰是该反应的催化剂,在反应前后质量不变,反应前后在没有其他的固体,故反应后称的固体的质量为2.5g;
(2)由题可知,生成氧气的质量为0.8g,设生成0.8g的氧气需要过氧化氢的质量为x,
2H2O2 MnO2 2H2O+O2↑
68 32
x 0.8g
![]() =
=![]() 求得x=1.7g
求得x=1.7g
原溶液中过氧化氢的质量分数为![]() =3.4%;
=3.4%;
答;滤渣的质量为2.5g,原溶液中溶质的质量分数为3.4%。

【题目】某化学兴趣小组发现将足量的铜片与浓硫酸混合加热,可以产生气体并闻到刺激性气味,反应停止后,所得溶液呈蓝色。同学们对产生的气体和所得溶液的成分产生了兴趣,进行了下列实验探究。
【探究活动1】产生的气体是什么?
【提出猜想】猜想一:SO2;猜想二: SO2和H2。你认为猜想______ 是错误的。
【查阅资料】(1) S02是一种无色,有刺激性气味,有毒的气体。(2)S02可使品红溶液的
红色褪去。(3) S02与C02有相似的化学性质。
【实验验证】小明用如下图所示的装置进行实验,观察到____________;证明该气体是二氧化硫,该装置中氢氧化钠溶液的作用__________________。
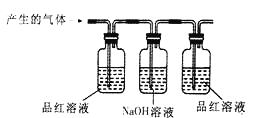
【探究活动2】蓝色溶液的溶质是什么?
【提出猜想】猜想一:CuS04;猜想二:CuS04和H2S04.
【进行实验】取一定量反应后的溶液进行稀释,并分装在A、B两支试管中,然后进行下列实验,并完成如表:
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤一 | 在试管A中加入少量的CuO粉末 | 黑色粉末逐渐溶解 | 溶液中含有H2SO4 o4 |
步骤二 | 在试管B中加入过量的NaOH溶液 | _____________。 | 溶液中含有CuS04 |
【结论】通过实验,猜想二正确。
【拓展与反思】(1)根据以上探究活动,请写出铜与浓硫酸发生反应的化学方程式__________。
(2)小华同学经过认真思考后认为:在“探究活动2”的实验中,步骤一是多余的,足量的铜片与浓硫酸的反应停止后,所得溶液中一定含H2S04,理由是____________________。