题目内容
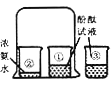
【题目】某化学兴趣小组发现将足量的铜片与浓硫酸混合加热,可以产生气体并闻到刺激性气味,反应停止后,所得溶液呈蓝色。同学们对产生的气体和所得溶液的成分产生了兴趣,进行了下列实验探究。
【探究活动1】产生的气体是什么?
【提出猜想】猜想一:SO2;猜想二: SO2和H2。你认为猜想______ 是错误的。
【查阅资料】(1) S02是一种无色,有刺激性气味,有毒的气体。(2)S02可使品红溶液的
红色褪去。(3) S02与C02有相似的化学性质。
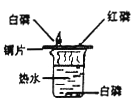
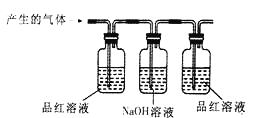
【实验验证】小明用如下图所示的装置进行实验,观察到____________;证明该气体是二氧化硫,该装置中氢氧化钠溶液的作用__________________。
【探究活动2】蓝色溶液的溶质是什么?
【提出猜想】猜想一:CuS04;猜想二:CuS04和H2S04.
【进行实验】取一定量反应后的溶液进行稀释,并分装在A、B两支试管中,然后进行下列实验,并完成如表:
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤一 | 在试管A中加入少量的CuO粉末 | 黑色粉末逐渐溶解 | 溶液中含有H2SO4 o4 |
步骤二 | 在试管B中加入过量的NaOH溶液 | _____________。 | 溶液中含有CuS04 |
【结论】通过实验,猜想二正确。
【拓展与反思】(1)根据以上探究活动,请写出铜与浓硫酸发生反应的化学方程式__________。
(2)小华同学经过认真思考后认为:在“探究活动2”的实验中,步骤一是多余的,足量的铜片与浓硫酸的反应停止后,所得溶液中一定含H2S04,理由是____________________。
【答案】 二 品红溶液的红色褪去 吸收二氧化硫,防止其污染空气 产生蓝色沉淀 Cu+2H2SO4(浓)![]() CuSO4+2H2O +SO2↑ 随着反应的进行,浓硫酸会逐渐变为稀硫酸,铜和稀硫酸不能反应。
CuSO4+2H2O +SO2↑ 随着反应的进行,浓硫酸会逐渐变为稀硫酸,铜和稀硫酸不能反应。
【解析】(3)【提出猜想】氢气是无色无味的气体,铜片在加热的条件下可以与浓硫酸反应,产生气泡并闻到刺激性气味,故猜想二错误;【实验验证】根据【查阅资料】(2)可知,S02可使品红溶液的红色褪去。小明用如下图所示的装置进行实验,观察到品红溶液的红色褪去,证明该气体是二氧化硫,该装置中氢氧化钠溶液的作用:吸收二氧化硫,防止其污染空气;【进行实验】步骤一:在试管A中加入少量的CuO粉末,(黑色)固体溶解,是氧化铜和硫酸反应生成硫酸铜和水,说明溶液中含有H2SO4;步骤二:在试管B中加入过量的NaOH溶液,氢氧化钠先和硫酸反应,硫酸被消耗完,氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀,说明溶液中含有CuSO4;【拓展与反思】(1)根据以上探究活动,铜与浓硫酸发生反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+2H2O +SO2↑;(2)小华同学经过认真思考后认为:在“探究活动2”的实验中,步骤一是多余的,足量的铜片与浓硫酸的反应停止后,所得溶液中一定含H2S04,理由是:随着反应的进行,浓硫酸会逐渐变为稀硫酸,铜和稀硫酸不能反应。
CuSO4+2H2O +SO2↑;(2)小华同学经过认真思考后认为:在“探究活动2”的实验中,步骤一是多余的,足量的铜片与浓硫酸的反应停止后,所得溶液中一定含H2S04,理由是:随着反应的进行,浓硫酸会逐渐变为稀硫酸,铜和稀硫酸不能反应。

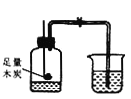
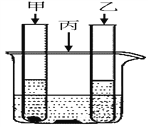
【题目】某化学兴趣小组用下图所示装置完成木炭还原氧化铜的实验,并对生成的红色固体成分进行探究。
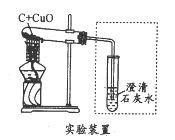
【提出问题】木炭与氧化铜反应生成的红色固体中含有什么物质?
【查阅资料】木炭与氧化铜反应也可能生成氧化亚铜(Cu2O);氧化亚铜是红色固体,能与稀硫酸反应: ![]() 。
。
【进行猜想】木炭与氧化铜反应生成的红色固体成分:
全部是铜;②全部是氧化亚铜;③是两者的混合物。
【实验探究】(1)用上图所示装置完成木炭还原氧化铜的实验,观察到澄清石灰水_______。试管冷却后,观察到黑色固体全部变为红色,对生成的红色固体成分进行探究:
实验探究
步骤 | 现象 | 结论 |
①取1.8g红色固体于试管中,滴加足量___________ ,充分反应 | ___________ | 猜想①错误 |
②过滤,将滤渣洗涤、干燥、称量 | 所得固体质量大于_______________ 克 | 猜想③正确 |