题目内容
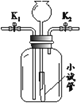
【题目】某同学用下图所示装置研究质量守恒定律的相关问题。
反应前称得总质量为m1,将足量稀硫酸全部倒入烧杯,充分反应后,称得总质量为m2。
(1)m1≠m2的原因是______(用化学方程式表示)。该反应是否遵守质量守恒定律______(填“是”或“否”)。
(2)理论上m1和m2的差值是______ g。
【答案】 Zn + H2SO4 === ZnSO4 + H2↑ 是 0.2
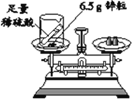
【解析】(1)根据锌与稀硫酸反应生成硫酸锌和氢气解答;凡是化学反应都遵守质量守恒定律;(2)根据锌的质量结合反应的化学方程式求生成氢气的质量。(1)锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式是Zn+H2SO4=ZnSO4+H2↑;该反应遵守质量守恒定律;
(2)设生成氢气的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g x
![]()
x=0.2g

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】20℃时,将不同质量的NaCl晶体分别加入100g水中,充分溶解后所得溶液质量与加入NaCl晶体质量的对应关系如下表:
组别 物质质量 | A | B | C | D | E |
NaCl晶体质量/g | 5 | 15 | 30 | 40 | |
所得溶液质量/g | 105 | 115 | X | 130 | 136 |
请回答下列问题,
(1)A组的溶液为 (填“饱和”或“不饱和”)溶液。
(2)C组X的值为 。
(3)如图为NaCl的溶解度曲线图,图上a点纵坐标的值为 。

Ca(OH)2的溶解度随温度变化的趋势与NaCl相反,则室温时,向饱和石灰水中加入少量生石灰,并恢复到室温,此时溶液中溶质的质量 (填“<”、“>”或“=”)原溶液中溶质的质量。
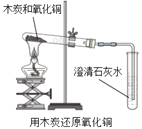
【题目】某化学兴趣小组用下图所示装置完成木炭还原氧化铜的实验,并对生成的红色固体成分进行探究。
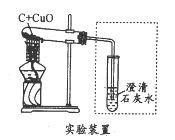
【提出问题】木炭与氧化铜反应生成的红色固体中含有什么物质?
【查阅资料】木炭与氧化铜反应也可能生成氧化亚铜(Cu2O);氧化亚铜是红色固体,能与稀硫酸反应: ![]() 。
。
【进行猜想】木炭与氧化铜反应生成的红色固体成分:
全部是铜;②全部是氧化亚铜;③是两者的混合物。
【实验探究】(1)用上图所示装置完成木炭还原氧化铜的实验,观察到澄清石灰水_______。试管冷却后,观察到黑色固体全部变为红色,对生成的红色固体成分进行探究:
实验探究
步骤 | 现象 | 结论 |
①取1.8g红色固体于试管中,滴加足量___________ ,充分反应 | ___________ | 猜想①错误 |
②过滤,将滤渣洗涤、干燥、称量 | 所得固体质量大于_______________ 克 | 猜想③正确 |
【题目】空气是我们赖以生存的宝贵资源。
(1)空气属于_____(填“纯净物”或“混合物”),其中能供给呼吸的物质是_____。
(2)下表为北京市某监测点监测到的空气质量。依据表格回答问题:

污染项目 | PM2.5 | PM10 | SO2 | CO | NO2 |
污染指数 | 69 | 95 | 9 | 0.8 | 42 |
①首要污染物是______;其中会形成酸雨的是______(填1种即可)。
② 上图为一款新型环保车,可通过360 °旋转的“大炮筒”向四周喷水,从而缓解极端恶劣天气给人带来的不适。分析这款环保车喷水的作用是______。
【题目】某化学兴趣小组利用下图装置进行实验。实验前K1、K2 均已关闭。
实验装置 | 【实验1】制取O2 | 【实验2】用NaOH溶液除去 O2中混有的CO2 |
| I.广口瓶中放入少量MnO2 II.打开K2,从长颈漏斗加入H2O2溶液至溢出小试管 | I.打开K1、K2,从长颈漏斗加入足量NaOH溶液至瓶中液面高于左侧导管口且低于小试管口 II. …… |
(1)连接仪器后,加水至长颈漏斗中形成液柱。一段时间后,液面高度保持不变,该现象说明______。
(2)实验1:制取O2的化学方程式是______。
(3)实验2:
①II中操作是:从______(填“左”或“右”)侧导气管通入混合气体。
②除去CO2 的反应如下,补全该反应的化学方程式:2NaOH + CO2 === Na2CO3 + ______
③实验过程中,当通入气体的流速突然变大时,小试管可以防止广口瓶中大量液体从长颈漏斗上口溢出,其原因是______。
【题目】对比、归纳是化学学习的重要方法,请补充完成下列实验报告。
【实验目的】探究物理变化和化学变化
【实验过程】
实验操作 | 实验现象、分析或结论 | |
实验一 | 步骤一:取少量硫酸铜晶体放在研钵内观察。 | 现象:晶体为蓝色 |
步骤二:用研杵将硫酸铜晶体研碎 | 现象:___________________。 | |
步骤三:在2支试管中分别放入少量研碎前、后的硫酸铜晶体,并进入少量水,振荡得到澄清的硫酸铜溶液 | 现象:研碎后的硫酸铜晶体溶解的更快。 分析:原因是_______________________。 | |
步骤四:向上述两支试管中各滴加少量氢氧化钠溶液 | 现象:2支试管中均有蓝色不溶物生成。 分析: (1)该反应的化学方程式是_________; (2)该对比实验得出的实验结论是_______。 | |
实验二 |
| 现象:有部分黑色粉末变红,澄清石灰水变浑浊。 分析: (1)粉末由黑色变成红色的过程中发生化学反应的化学方程式是___________; (2)上述现象说明木炭和氧化铜发生了化学变化。 |
【实验结论】有他物质生成的变化叫化学变化,没有其他物质生成的变化叫物理变化。
【题目】央视频道《是真的吗?》栏目中有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。据此,某同学取“锡纸”进行了以下探究:
探究一:“锡纸”燃烧的原因
“锡纸”两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件分析:开始“锡纸”不燃烧但短路后却能燃烧的原因是___________。
探究二:“锡纸”中金属的成分
【提出问题】“锡纸”中的金属是锡吗?
【查阅资料】①“锡纸”是锡箔或铝箔
②锌粉是一种深灰色固体
③锡(Sn)与酸或与某些金属化合物溶液反应生成+2价锡的化合物
【提出猜想】猜想Ⅰ:“锡纸”中的金属是锡 猜想Ⅱ:“锡纸”中的金属是铝
【进行实验】设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序 可知猜想___(填“Ⅰ”或“Ⅱ”)成立; 反应的化学方程式为______________ |
【交流讨论】
(1)实验中打磨“锡纸”的目的是_______________
(2)下列物质的溶液可以替代氯化锌溶液完成上述实验的是___填字母序号).
A.氯化铜 B.硝酸银 C.硫酸钠 D.硫酸亚铁
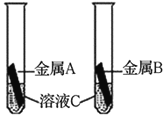
【拓展应用】证明铁、铜、银三种金属活动性顺序的实验方案如下,请将内容补充完整。
C是__________________ 溶液。
实验操作 | 实验现象 | 实验结论 |
| _____________ | 铁、铜、银三种金属的活动性顺序是:Fe>Cu>Ag |