题目内容
【题目】在学习了盐的性质后,同学们分组对碳酸氢钠的化学性质进行探究。
(查阅资料)碳酸氢钠受热分解生成一种固体、一种液体和一种气态的氧化物;碳酸钠受热不分解。
探究环节 | 甲组的探究 | 乙的探究 |
(提出问题) | 碳酸氢钠溶液的酸碱性? | 碳酸氢钠受热分解后产物是什么? |
(猜想假设) | 猜想一:碳酸氢钠构成中含有氢离子,溶液显酸性 猜想二:碳酸氢钠构成中含有碳酸根离子,溶液显碱性 | 猜想一:碳酸钠、水和二氧化碳 猜想二:氢氧化钠、水和二氧化碳 |
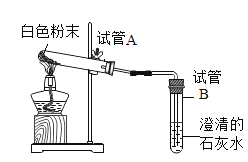
(实验验证) | (1)小红将pH试纸用蒸馏水润湿后测得碳酸氢钠溶液的pH=8。小明认为小红的操作有误,请你简述错误所在及对检验碳酸氢钠溶液的酸碱性是否有影响?_____ (2)小明取少量碳酸氢钠溶液,滴入酚酞溶液,溶液____________,证明猜想二正确 | (1)取少量干燥后的碳酸氢钠粉末按图进行操作:
观察到试管A的试管口有无色流体,试管B澄清石灰水变浑浊,试管B中发生反应的化学方程式是________ (2)待完全反应后,取冷却后的白色粉末溶于水,滴入氢氧化钙溶液,观察到_________,猜想一成立 |
(反思交流)乙组的实验(1)中取干燥后的碳酸氢钠粉末的意图是_________________________。
(拓展迁移)请你设计一种区别碳酸钠和碳酸氢钠的简易方案:________________________。
【答案】将pH试纸用蒸馏水润湿后,测得碳酸氢钠溶液的pH有误差但不影响结论(只要答不能用水润湿pH试纸,无影响即可给分) 变红 Ca(OH)2+CO2=CaCO3↓+H2O 有白色沉淀生成 排除对检验有水生成的干扰 加热后用澄清石灰水检验生成物
【解析】
[实验验证]
甲组探究:
(1)将pH试纸用蒸馏水润湿后,测得的碳酸氢钠溶液的pH会偏小,但是碱性溶液无论怎么稀释,它仍是碱性溶液,pH永远大于7,因此,湿润的pH试纸不会影响对于酸碱性的检测,故填写:将pH试纸用蒸馏水润湿后,测得碳酸氢钠溶液的pH有误差但不影响结论;
(2) 猜想二正确,说明溶液显碱性,因此,当碳酸氢钠溶液,滴入酚酞溶液,溶液变红,故填写:变红;
乙组探究:
(1)澄清石灰水的溶质是氢氧化钙,它与二氧化碳反应生成沉淀碳酸钙和水,故填写:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)猜想一成立,说明白色粉末为碳酸钠,溶于水,滴入氢氧化钙溶液,碳酸钠与氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠,因此,观察到:有白色沉淀生成,故填写:有白色沉淀生成;
[反思交流]
该实验猜想中生成物有水,实验(1)中取干燥后的碳酸氢钠粉末可以避免对生成物水的检测干扰,故填写:排除对检验有水生成的干扰;
[拓展迁移]
由资料可知,碳酸钠受热不分解,而碳酸氢钠受热易分解,可以对两者进行加热,加热后,用澄清石灰水检验生成气体,产生气体能使澄清石灰水变浑浊的粉末为碳酸氢钠,故填写:加热后用澄清石灰水检验生成物。

 名校课堂系列答案
名校课堂系列答案【题目】甲、乙、丙三种同体物质的溶解度曲线如图所示,请回答下列问题:
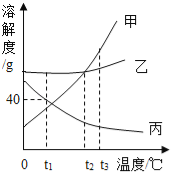
(1)t1℃时,三种物质中溶解度最大的是 .
(2)使t3℃时接近饱和的甲溶液变为饱和溶液,可采用的一种方法是 .
(3)t1℃时,将50g水放入盛有30g丙物质的烧杯中,充分搅拌,所得溶液的质量为 g.
(4)将t3℃时甲、乙两种物质的饱和溶液降温到t2℃,析出晶体的质量关系为 (填字母).
A.甲>乙 | B.甲<乙 | C.甲=乙 | D.无法确定 |
【题目】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,同时还生成氯化钠(![]() )。烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如表所示:
)。烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如表所示:
次数 | 累计加入氯化钙溶液的质量/g | 烧杯中溶液的总质量/g |
一 | 40 | 134 |
二 | 80 | 168 |
三 | 120 | 202 |
四 | 150 | 232 |
(1)恰好完全反应时,生成沉淀的总质量为_____g。
(2)计算氯化钙溶液的溶质质量分数_____。