��Ŀ����
����Ŀ��ʵ������̼������Һ���Ȼ�����Һ��Ӧ��ȡ�ߴ���̼��Ʒ�ĩ��ͬʱ�������Ȼ��ƣ�![]() �����ձ�������100g̼������Һ����150g�Ȼ�����Һ���Ĵμ��룬��ַ�Ӧ���Ĵβ����������������ʾ��
�����ձ�������100g̼������Һ����150g�Ȼ�����Һ���Ĵμ��룬��ַ�Ӧ���Ĵβ����������������ʾ��
���� | �ۼƼ����Ȼ�����Һ������/g | �ձ�����Һ��������/g |
һ | 40 | 134 |
�� | 80 | 168 |
�� | 120 | 202 |
�� | 150 | 232 |
��1��ǡ����ȫ��Ӧʱ�����ɳ�����������Ϊ_____g��
��2�������Ȼ�����Һ��������������_____��
���𰸡�18 16.65%
��������
��1�����ݵ�һ������������100g+40g-134g=6g���ڶ�������������100g+80g-168g=12g������������������100g+120g-202g=18g�����Ĵ� ����������100g+150g-232g=18g����������ǡ����ȫ��Ӧ��ǡ����ȫ��Ӧ���ɳ���������Ϊ18g��
��2������ǰ���ζ����Լ����Ȼ�����Һ����������������
�Ե�һ��ʵ�����ݼ������£�
���Ȼ�����Һ��������������Ϊx����ʱ���ɵij���������Ϊ6g����Ӧ���Ȼ�����Һ������Ϊ40g��

![]()
��ã�x=16.65%
���Ȼ�����Һ��������������Ϊ16.65%��

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�����Ŀ����ѧϰ���ε����ʺ�ͬѧ�Ƿ����̼�����ƵĻ�ѧ���ʽ���̽����
���������ϣ�̼���������ȷֽ�����һ�ֹ��塢һ��Һ���һ����̬�������̼�������Ȳ��ֽ⡣
̽������ | �����̽�� | �ҵ�̽�� |
��������⣩ | ̼��������Һ������ԣ� | ̼���������ȷֽ�������ʲô�� |
��������裩 | ����һ��̼�����ƹ����к��������ӣ���Һ������ �������̼�����ƹ����к���̼������ӣ���Һ�Լ��� | ����һ��̼���ơ�ˮ�Ͷ�����̼ ��������������ơ�ˮ�Ͷ�����̼ |
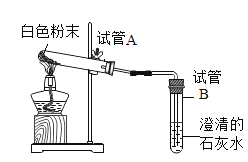
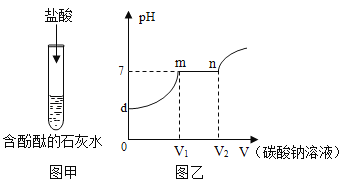
��ʵ����֤�� | ��1��С�콫pH��ֽ������ˮ��ʪ����̼��������Һ��pH=8��С����ΪС��IJ���������������������ڼ��Լ���̼��������Һ��������Ƿ���Ӱ�죿_____ ��2��С��ȡ����̼��������Һ�������̪��Һ����Һ____________��֤���������ȷ | ��1��ȡ����������̼�����Ʒ�ĩ��ͼ���в�����
�۲쵽�Թ�A���Թܿ�����ɫ���壬�Թ�B����ʯ��ˮ����ǣ��Թ�B�з�����Ӧ�Ļ�ѧ����ʽ��________ ��2������ȫ��Ӧ��ȡ��ȴ��İ�ɫ��ĩ����ˮ����������������Һ���۲쵽_________������һ���� |
����˼�����������ʵ��(1)��ȡ������̼�����Ʒ�ĩ����ͼ��_________________________��
����չǨ�ƣ��������һ������̼���ƺ�̼�����Ƶļ�������________________________��