��Ŀ����
����Ŀ�������뻯ѧ��ϵ����,2019��6��1�����ݵ���һ���߽��������нΡ�
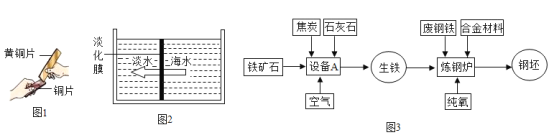
(1)�����г��ij��彨����Ҫ���Ĵ��������Ͻ�������ؿ������ĺ���_________________(����ڡ����ڡ�)������������Ⱦ��к�ǿ�Ŀ���ʴ��,��ԭ����___________________����ҵ�ϳ���һ ����̼�ͳ�����ʯ(��Ҫ�ɷ���������)�ڸ���������ұ������,�÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
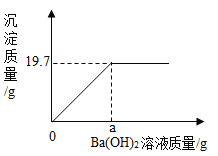
(2)ijƷ�ƵĿ������������й�������(Na2O2),������ʹ������Ķ�����̼ת��Ϊ����,��Ӧ�Ļ�ѧ����ʽΪ![]() ����X�Ļ�ѧʽΪ__________________��
����X�Ļ�ѧʽΪ__________________��
���𰸡����� ����������Ӧ�������ı����γ�һ�����ܵ������ﱡĤ 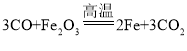
![]()
��������
(1)�ؿ���Ԫ�غ���ǰ��λ��Ԫ���������衢���������ؿ������ĺ�������������������Ⱦ��к�ǿ�Ŀ���ʴ�ԣ���ԭ��������������Ӧ�������ı����γ�һ�����ܵ������ﱡĤ����ҵ�ϳ���һ����̼�ͳ�����ʯ(��Ҫ�ɷ���������)�ڸ���������ұ��������һ����̼�������������ڸ����·�Ӧ�������Ͷ�����̼���÷�Ӧ�Ļ�ѧ����ʽΪ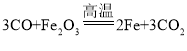 ��
��
(2)�������������(Na2O2)����ʹ������Ķ�����̼ת��Ϊ��������Ӧ�Ļ�ѧ����ʽΪ![]() �����������غ㶨�ɣ���Ӧǰ��ԭ�ӵ��������Ŀ���ֲ��䣬��X�Ļ�ѧʽΪ
�����������غ㶨�ɣ���Ӧǰ��ԭ�ӵ��������Ŀ���ֲ��䣬��X�Ļ�ѧʽΪ![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
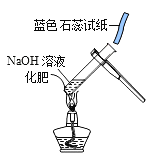
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ͼ��ʾ��ʵ��̨�ϰ��բ�~��˳��ڷŵ���ƿ��ɫ�Լ���ҩƷ�ǰ��������������ڷŵģ�,�����Լ��ܵı�ǩ����Ϊ̽���Լ��ܵijɷֽ���������̽�����
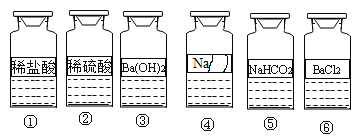
[�������]�Լ��ܵijɷ���ʲô?
[��������]����������ı�ǩ����ҩƷ�İڷ�˳��,���Լ��ܵijɷֽ����������Ʋ�:
�����Լ�����ͬ������ | �����Լ�����ͬ������ | |
����1��___________ | ����2:Na2CO3 | ����3:______����дһ�֣� |
[����ʵ��]Ϊ��֤����2�Ƿ���ȷ,С��ͬѧ����������ʵ�顣
ʵ��1 :��pH��ֽ�ⶨ�Լ�����Һ��pH=11��С��ݴ˵ó�������2��ȷ���Ľ���,С��ͬѧ������ΪС����ƶϲ�����,���ǵ�������________��
ʵ��2 :��ʢ���Լ��ܵ���Һ�м���______������ɫ��ζ���������;������������ͨ�����ʯ��ˮ�У����ֵ�����Ϊ____��С��ͬѧ�ݴ˵ó�����:����2��ȷ��
ʵ��3 :��ʢ���Լ��ܵ���Һ�м����Ȼ�����Һ�����ְ�ɫ��������������ϡ���ᣬ��ɫ����ȫ���ܽ�,�Ӷ���һ��֤������2��ȷ������ɫ�����ܽ����Ļ�ѧ����ʽΪ______��
[��չӦ��]Ϊ��ֹ�Լ�ƿ�ı�ǩ������ʵ�����������Ӧע�����____��
����Ŀ����ѧϰ���ε����ʺ�ͬѧ�Ƿ����̼�����ƵĻ�ѧ���ʽ���̽����
���������ϣ�̼���������ȷֽ�����һ�ֹ��塢һ��Һ���һ����̬�������̼�������Ȳ��ֽ⡣
̽������ | �����̽�� | �ҵ�̽�� |
��������⣩ | ̼��������Һ������ԣ� | ̼���������ȷֽ�������ʲô�� |
��������裩 | ����һ��̼�����ƹ����к��������ӣ���Һ������ �������̼�����ƹ����к���̼������ӣ���Һ�Լ��� | ����һ��̼���ơ�ˮ�Ͷ�����̼ ��������������ơ�ˮ�Ͷ�����̼ |
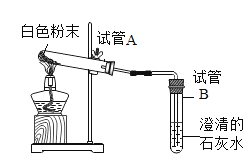
��ʵ����֤�� | ��1��С�콫pH��ֽ������ˮ��ʪ����̼��������Һ��pH=8��С����ΪС��IJ���������������������ڼ��Լ���̼��������Һ��������Ƿ���Ӱ�죿_____ ��2��С��ȡ����̼��������Һ�������̪��Һ����Һ____________��֤���������ȷ | ��1��ȡ����������̼�����Ʒ�ĩ��ͼ���в�����
�۲쵽�Թ�A���Թܿ�����ɫ���壬�Թ�B����ʯ��ˮ����ǣ��Թ�B�з�����Ӧ�Ļ�ѧ����ʽ��________ ��2������ȫ��Ӧ��ȡ��ȴ��İ�ɫ��ĩ����ˮ����������������Һ���۲쵽_________������һ���� |
����˼�����������ʵ��(1)��ȡ������̼�����Ʒ�ĩ����ͼ��_________________________��
����չǨ�ƣ��������һ������̼���ƺ�̼�����Ƶļ�������________________________��