题目内容
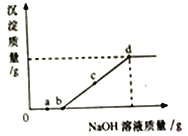
【题目】在一烧杯中盛有 200gBaCl2和 HCl 的混合溶液,向其中逐滴滴入溶质质量分数为10%的Na2CO3溶液,烧杯中溶液的质量与所滴入Na2CO3溶液的质量关系曲线如图1所示,请根据题意回答问题:

(1)实验过程中放出气体的质量为 g。
(2)原混合溶液中 BaCl2的质量分数为多少?(写出计算过程)
(3)根据计算所得数据在图 2 中画出产生沉淀的曲线。
(4)当入Na2CO3溶液至图中B 点时,所得溶液中溶质的质量分数是 (结果精确到1%,即%号前取整数)。
【答案】(1)4.4;(2) 解:设原混合溶液中 BaCl2的质量分数为y生成碳酸钡的质量为z。由图1可知氯化钡消耗的碳酸钠溶液质量为212g-106g=106g。

答:原混合溶液中 BaCl2的质量分数为10.4%
;(3)  ;(4)6%
;(4)6%
【解析】
加入碳酸钠之后最初碳酸钠和盐酸反应,盐酸反应完之后,继续加碳酸钠碳酸钠和氯化钡反应。
(1)解:设加入碳酸钠之后生成二氧化碳质量为x
 故填:4.4
故填:4.4
(2)解:设原混合溶液中 BaCl2的质量分数为y生成碳酸钡的质量为z。由图1可知氯化钡消耗的碳酸钠溶液质量为212g-106g=106g。

答:原混合溶液中 BaCl2的质量分数为10.4%
(3)分析图1可得当加入碳酸钠质量为106g时开始产生沉淀,碳酸钠溶液质量为212g时沉淀质量最大,通过计算可知沉淀质量为19.7g,故产生沉淀的曲线为:
(4)解:设反应生成氯化钠质量为为m,由反应Na2CO3+2HCl=2NaCl+CO2↑+H2O以及反应Na2CO3+BaCl2=2NaCl+BaCO3↓可得;

根据质量守恒溶液质量为:212g+200g-4.4g-19.7g=387.9g
故溶液溶质质量分数;
![]()
故填:6%。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】根据下列仪器装置,回答有关问题。


(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是__________ (用化学式表示);实验结束熄灭酒精灯的操作为__________。
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为_______________。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为_____→ H → _____ →干燥、纯净CO2 (在横线内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
(提出问题)制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3 + CO2 + H2O = 2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
(查阅资料)碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3 =Na2CO3 + H2O;Ca(HCO3)2溶于水。
(猜想)所得溶液中的溶质是:I.Na2CO3;II.NaHCO3;III.Na2CO3和NaHCO3;IV._____。
(实验)请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 | 现象 | 分析 |
取少量反应后的溶液,加入足量的CaCl2溶液 | __________ | 发生反应的方程式:_____ |
__________ | 产生白色沉淀 | 结论:猜想III正确 |
(讨论)二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是________。
【题目】请完成下列实验,回答问题。

(1)通过水的电解认识水:
①宏观现象:按图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_______。
②微观该反应中发生分解的微粒名称是___________。
③结论:水由_________组成。
(2)下列依据实验目的所设计的实验操作中,正确的是_______(可能有多个正确选项)
选项 | 实验目的 | 实验操作 |
A | 除去CO2混有HCl气体 | 将气体通过足量NaOH溶液 |
B | 鉴别NH4Cl和KCl两种白色固体肥料 | 加入熟石灰研磨后闻气味 |
C | 检验生石灰中是否有未分解的石灰石 | 滴加稀盐酸观察现象 |
D | 除去二氧化碳中的一氧化碳 | 将气体点燃 |