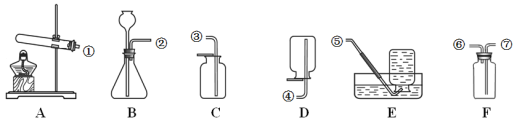
题目内容
【题目】根据下列实验方案进行实验,能达到相应实验目的是( )
A.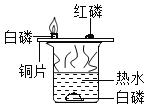 探究燃烧条件之一需要可燃物
探究燃烧条件之一需要可燃物
B.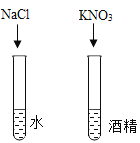 探究影响物质溶解性的因素
探究影响物质溶解性的因素
C.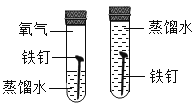 探究铁钉生锈需要氧气
探究铁钉生锈需要氧气
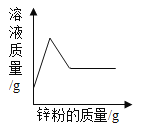
D. 比较Zn和Fe的金属活动性强弱
比较Zn和Fe的金属活动性强弱
【答案】C
【解析】
A. 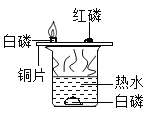 图中白磷、红磷都是可燃物,无法探究燃烧条件之一需要可燃物;该实验可以探究燃烧需要氧气和温度达到可燃物的着火点。故A不符合题意;
图中白磷、红磷都是可燃物,无法探究燃烧条件之一需要可燃物;该实验可以探究燃烧需要氧气和温度达到可燃物的着火点。故A不符合题意;
B. 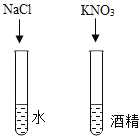 该组探究有两个变量,溶质种类不同和溶剂种类不同,没有控制变量,所以无法比较。探究影响物质溶解性的因素时:必须控制变量。故B不符合题意;
该组探究有两个变量,溶质种类不同和溶剂种类不同,没有控制变量,所以无法比较。探究影响物质溶解性的因素时:必须控制变量。故B不符合题意;
C. 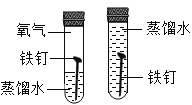 这组对比试验控制的变量就是氧气,左边试管有氧气,右边试管没有,其它条件都相同,所以可以探究铁钉生锈需要氧气。故C符合题意;
这组对比试验控制的变量就是氧气,左边试管有氧气,右边试管没有,其它条件都相同,所以可以探究铁钉生锈需要氧气。故C符合题意;
D.  该组实验没有控制变量,有两个变量,金属种类和盐酸浓度,无法比较Zn和Fe的金属活动性强弱受这两个因素中的哪个影响。故D不符合题意。
该组实验没有控制变量,有两个变量,金属种类和盐酸浓度,无法比较Zn和Fe的金属活动性强弱受这两个因素中的哪个影响。故D不符合题意。
故选C。

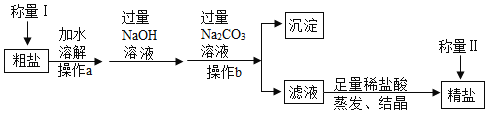
【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
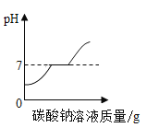
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
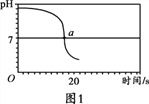
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。

【解释与结论】
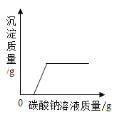
(1)实验1得出三种溶液的碱性由强到弱的顺序为________________。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是_________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_________。
(3)实验3中,b点的溶质为_________,c点后发生反应的化学方程式为_________。
(4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为_________。
【题目】根据下列仪器装置,回答有关问题。
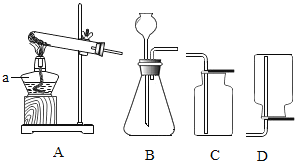
(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是__________ (用化学式表示);实验结束熄灭酒精灯的操作为__________。
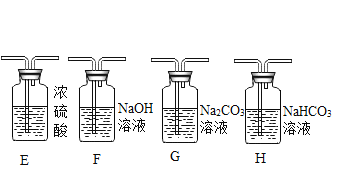
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为_______________。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为_____→ H → _____ →干燥、纯净CO2 (在横线内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
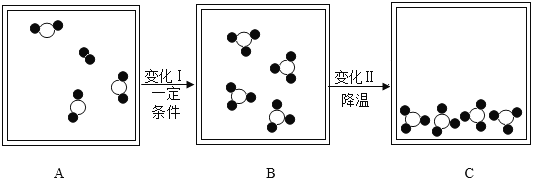
(提出问题)制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3 + CO2 + H2O = 2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
(查阅资料)碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3 =Na2CO3 + H2O;Ca(HCO3)2溶于水。
(猜想)所得溶液中的溶质是:I.Na2CO3;II.NaHCO3;III.Na2CO3和NaHCO3;IV._____。
(实验)请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 | 现象 | 分析 |
取少量反应后的溶液,加入足量的CaCl2溶液 | __________ | 发生反应的方程式:_____ |
__________ | 产生白色沉淀 | 结论:猜想III正确 |
(讨论)二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是________。