题目内容
【题目】实验室有一瓶失去标签的过氧化氢溶液,为测定其溶质质量分数,兴趣小组同学取l00g该溶液与1g二氧化锰混合,使其充分反应,产生气体的质量和反应时间关系如图。
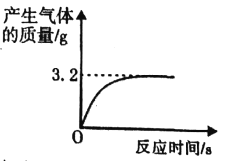
(1)完全反应后,经过滤、烘干,得到固体的质量为_______(不计操作过程中的损耗)
(2)产生气体的速度越来越慢的原因是_______。
A.二氧化锰越来越少
B.过氧化氢溶液的溶质质盘分数越来越小
D.温度越来越高
(3)计算所用过氧化氢溶液的溶质质量分数。(规范写出计算过程)
【答案】(1)1g(2)B (3)6.8%
【解析】(1)催化剂在反应前后质量不变,所以反应后固体质量仍为1g。
(2)反应物浓度降低,导致反应物接触不太充分,反应速率会减慢;温度升高,通常是加快反应速率;
(3)设所用过氧化氢溶液的溶质质量为x,
2H2O2 MnO2 2H2O+O2↑
68 32
x 3.2g
68/x=32/3.2g x=6.8g
所用过氧化氢溶液的溶质质量分数为6.8g÷l00g×100%=6.8%
答:略

 名校课堂系列答案
名校课堂系列答案【题目】(1)如图是实验室制取气体的一些装置,据图回答:
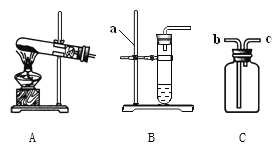
①图B中仪器a的名称是________________。
②用高锰酸钾制取氧气的发生装置是_____________(填序号),若用C装置手机氧气,验满时,应将带木星的木条放在_____________(填“b”或“c”)端导口,若木条复燃,说明氧气已满。
(2)小明在帮老师整理实验室时,发现一瓶为密封的KOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究。
[查阅资料]:①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是____________。
②K2CO3溶液呈碱性,BaCl2溶液、KCl溶液呈中性。
[猜想假设]:假设Ⅰ:只含KOH;假设Ⅱ:含KOH和K2CO3;假设Ⅲ:只含K2CO3
[进行实验]:
实验操作步骤 | 实验现象 | 实验结论 |
① 取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设______不正确 |
② 另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置 | ————————— | 假设Ⅲ正确 |
③ 取②中上层清液,滴加无色酚酞溶液 | ————————— |
[问题讨论]:步骤②中加入过量BaCl2溶液的作用是_____________________。
[拓展应用] :完全变质的KOH也有利用价值,从K2CO3的组成或性质看,这瓶变质的试剂在农业上的用途是_________________________________。

