题目内容
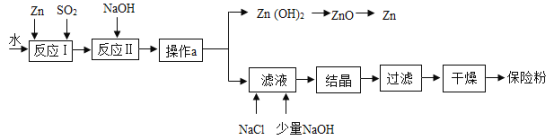
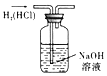
【题目】化学兴趣小组的同学想利用某矿石制备氢氧化镁,已知该矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,制备的流程如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。

请回答下列问题:
(1)溶液 A 中的阳离子除了 Mg2+、Fe3+、Cu2+外,还含有_____。写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:_____(只写一个)。
(2)在溶液 A 中加入熟石灰调节溶液的 pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关 pH 数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液 B 的 pH 的取值范围为_____。
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀时的 pH | 1.5 | 4.2 | 8.6 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液 B 中加入熟石灰发生的化学反应方程式:_____。
【答案】H+ ![]() (或
(或![]() 或
或![]() ) 6.7≤pH<8.6
) 6.7≤pH<8.6 ![]()
【解析】
(1)溶液A pH<1,溶液 A 中的阳离子除了 Mg2+、Fe3+、Cu2+外,还含有氢离子(H+);氧化镁和稀盐酸反应生成氯化镁和水,氧化铁和稀盐酸反应生成氯化铁和水,氧化铜和稀盐酸反应生成氯化铜和水,化学方程式分别为:![]() ,
,![]() ,
,![]() ;
;
(2)由表中数据可知,溶液B的pH控制在6.7-8.6时,铁离子、铜离子分别以氢氧化铁、氢氧化铜沉淀析出,而镁离子仍然在溶液中;为保证产品纯度、减少产品损失,并便于操作,所得溶液 B 的 pH 的取值范围为6.7≤pH<8.6;
(3)氯化镁和氢氧化钙反应生成氯化钙和氢氧化镁沉淀,化学方程式为:![]() 。
。

 计算高手系列答案
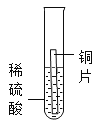
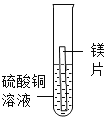
计算高手系列答案【题目】“克罗米”技术是指在眼镜的金属镜架、自行车车把与钢圈等金属表面镀上一层金属铬(Cr)。小明发现在常见金属活动性顺序中没有铬,于是他和小组同学一起探究铬与常见金属镁和铜的活动性强弱。
(查阅资料)铬(Cr) 是一种银白色金属,在空气中能形成一层致密的氧化膜,可阻止铬进一步被氧化;硫酸亚铬(CrSO4) 溶液呈蓝色,硫酸亚铬中铬元素的化合价为__。
(提出猜想)三种金属的活动性强弱为:
①Cr> Mg>Cu ②Mg>Cu>Cr ③____
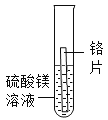
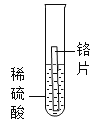
[实验探究]
实验1 | 实验2 | 实验3 | 实验4 | |
实验方案 |
|
|
|
|
现象 | 无明显现象 | 铬片上有气泡产生,溶液逐渐变成蓝色 | 无明显现象 | ___ |
结论 | 猜想___正确 | |||
(交流与讨论)
(1)实验前所用的金属片都需用砂纸打磨,其目的是__。
(2)实验4中反应的化学方程式为___。
(3)结合探究结论,有同学提出四个实验可进行优化,只需选择三种药品,即可金属的活动性强弱。合理的选择是_____。
①硫酸镁溶液②硫酸亚铬溶液③硫酸铜溶液④稀硫酸⑤镁片⑥铬片⑦铜片