题目内容
【题目】在微观、宏观及符合之间建立联系是化学学科的特点之一。请分析并回答下列问题:
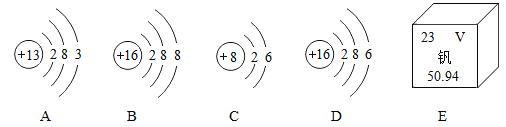
(1)图E所示元素的原子核内质子数为__________________。
(2)在A~D中,共有___________种不同元素
(3)A、C所表示的元素形成的化合物的化学式为_____________________。
【答案】23 3 Al2O3
【解析】
(1)根据元素周期表中的一格中获取的信息,该元素的原子序数为23;根据原子序数=核电荷数=质子数=核外电子数,则E原子核内的质子数为23。
故填:23。
(2)在A~D中,B和D的质子数相同,属于同种元素,共有三种不同元素。
故填:3。
(3)A的最外层电子数为3,容易失去3个电子,带三个单位的正电荷,可以表示为Al3+,C的最外层电子数为6,容易得到2个电子,带2个点位的负电荷,可以表示为O2-.根据化合物各元素正负化合价代数和为零,可知A、C所表示的元素形成的化合物的化学式为Al2O3。
故填:Al2O3。

 阅读快车系列答案
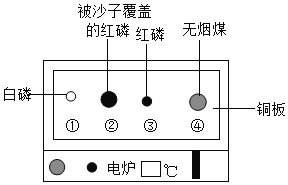
阅读快车系列答案【题目】综合实践课上,实验小组同学参观了某工厂的废水处理车间,绘制得右图所示废水处理流程图,了解得知A管道中流出的废水中含有碳酸钠和氢氧化钠,B管道流出的废水中含有稀盐酸和氯化钡,A、B管中废液首先进入废水池,经过滤网进入处理池中。经过D口和E口向处理池中加入处理剂,达标后经C口排出。同学们从废水池中取了一些物质带回实验室,静置后有白色沉淀,过滤后得到上层清液。
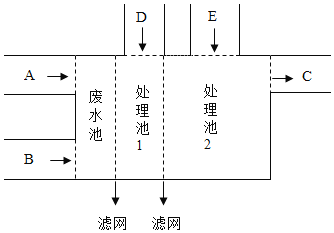
[提出问题]上层清液中含有哪些离子?
[作出猜想]
猜想Ⅰ.Na+、Cl-、H+
猪想Ⅱ.Na+、Cl-、OH-、Ba2+
猜想Ⅲ.Na+、Cl-、OH-、CO32-
上述有一个猜想不合理,请你指出并说明理由_____________。
[进行实验]
实验步骤 | 实验现象及化学方程式 | 实验结论 | |
步骤一:取少量溶液于试管中,向其中滴加____________。 | 现象:有白色沉淀生成化学方程式:___________。(写出一个即可) | 有Ba2+ | 猜想Ⅱ正确 |
步骤二:另取少量溶液于试管中,滴加少量的___________。 | 现象:溶液变为红色 | 有OH- | |
[反思评价]
(1)步骤一中反应的实质是____________。
(2)小红认为步骤二不能证明溶液中有OH-,溶液中有CO32-也会产生相同的实验现象,请你对她的观点进行评价__________。
(3)小花认为没有检验Na+和Cl-,实验过程不完整。你是否同意小花的观点,请说明理由______。
(4)为节能环保,回收利用。可以通过D口向处理池中加入足量的碳酸钠溶液,通过E口加入足量的_____,将处理池中废水转化为NaCl溶液,从出口C排出,然后蒸发结晶,得到NaCl固体。
【题目】化学兴趣小组的同学想利用某矿石制备氢氧化镁,已知该矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,制备的流程如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。

请回答下列问题:
(1)溶液 A 中的阳离子除了 Mg2+、Fe3+、Cu2+外,还含有_____。写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:_____(只写一个)。
(2)在溶液 A 中加入熟石灰调节溶液的 pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关 pH 数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液 B 的 pH 的取值范围为_____。
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀时的 pH | 1.5 | 4.2 | 8.6 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液 B 中加入熟石灰发生的化学反应方程式:_____。
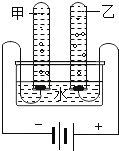
【题目】甲乙两位同学在学完酸碱盐的化学性质之后,分别作了如图所示的实验。
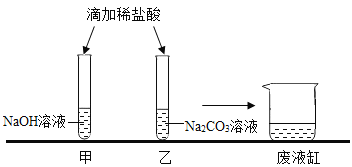
(观察与讨论1)
(1)甲同学实验中没有观察到明显的现象,他认为二者没有发生反应。为证明甲同学试管中的物质能反应,先向NaOH溶液中滴几滴____________________(填指示剂名称)试液,再滴加适量的稀盐酸,当观察到颜色变化时,就可以说明两种物质发生了反应。
(2)乙同学实验中发生反应的化学方程式为_____________________。
(观察与讨论2)实验结束后,甲、乙两位同学依次将各自试管中的废液倒入同一个洁净的废液缸中,形成无色溶液。甲同学取少量废液于试管中,滴入无色酚酞试液,发现溶液呈红色,则该废液中的溶质一定不含_______________________________ (填化学式)。
为了科学处理废液,两位同学决定对废液缸中最终的废液进行探究。
(提出问题)最终废液中除含NaCl外,还含有其它什么溶质?
(作出猜想)猜想I:还含有Na2CO3;
猜想Ⅱ:还含有NaOH;
猜想Ⅲ:还含有_______________________。
(进行实验)甲同学的实验过程如表所示,请你完成如表所示的实验报告:(已知CaCl2溶液呈中性)
实验步骤 | 实验现象 | 实验结论 |
1.测定废液的pH | pH>7 | 废液中含有NaOH |
2.取少量废液于试管中,加入过量氯化钙溶液,再滴入无色酚酞试液 | ___________________ | 猜想Ⅲ成立 |
(反思与交流)乙同学认为甲同学步骤1的结论不正确,原因是______________。
【题目】下表是元素周期表的一部分,试回答下列问题:
第一周期 | 1H | 2He | ||||||
第二周期 | 3Li | 4Be | 5B | 6C | ① | ② | 9F | 10Ne |
第三周期 | 11Na | 12Mg | ③ | 14Si | 15P | 16S | 17Cl | 18Ar |
(1)①所示元素是__________(填“金属元素”或“非金属元素”);
(2)②所示元素与③所示元素形成的化合物的化学式是_____;
(3)下图是某元素的原子结构示意图,该原子在化学反应中易__________电子;离子符号为____________ 。

(4)下图是某元素的原子结构示意图,该元素的原子核外电子数为____。