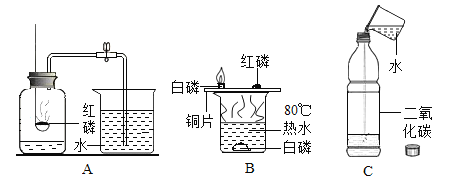
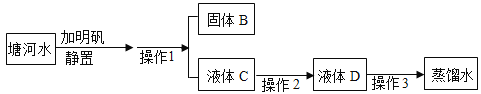
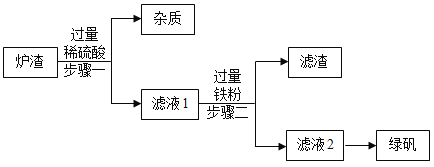
题目内容
【题目】“克罗米”技术是指在眼镜的金属镜架、自行车车把与钢圈等金属表面镀上一层金属铬(Cr)。小明发现在常见金属活动性顺序中没有铬,于是他和小组同学一起探究铬与常见金属镁和铜的活动性强弱。
(查阅资料)铬(Cr) 是一种银白色金属,在空气中能形成一层致密的氧化膜,可阻止铬进一步被氧化;硫酸亚铬(CrSO4) 溶液呈蓝色,硫酸亚铬中铬元素的化合价为__。
(提出猜想)三种金属的活动性强弱为:
①Cr> Mg>Cu ②Mg>Cu>Cr ③____
[实验探究]
实验1 | 实验2 | 实验3 | 实验4 | |
实验方案 |
|
|
|
|
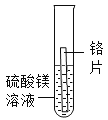
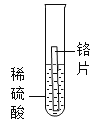
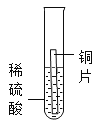
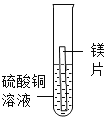
现象 | 无明显现象 | 铬片上有气泡产生,溶液逐渐变成蓝色 | 无明显现象 | ___ |
结论 | 猜想___正确 | |||
(交流与讨论)
(1)实验前所用的金属片都需用砂纸打磨,其目的是__。
(2)实验4中反应的化学方程式为___。
(3)结合探究结论,有同学提出四个实验可进行优化,只需选择三种药品,即可金属的活动性强弱。合理的选择是_____。
①硫酸镁溶液②硫酸亚铬溶液③硫酸铜溶液④稀硫酸⑤镁片⑥铬片⑦铜片
【答案】+2 Mg>Cr>Cu 镁片表面有红色物质析出,溶液逐渐变成无色 ③ 除去金属片表面的氧化膜或污物 ![]() ①③⑥(或②⑤⑦)
①③⑥(或②⑤⑦)
【解析】
根据金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来分析解答。
[查阅资料]硫酸亚铬中硫酸根化合价是-2,根据化合物中元素化合价代数和为零可知,铬元素的化合价为+2。故填:+2。
[提出猜想]三种金属的活动性强弱为:①Cr>Mg>Cu ②Mg>Cu>Cr ③Mg>Cr>Cu。故填:Mg>Cr>Cu。
[实验探究]实验1中无明显现象,说明镁比铬活泼,实验2中铬片上有气泡产生,溶液逐渐变成蓝色,说明铬排在氢前面,实验3中无明显现象,说明铜排在氢后面,镁和硫酸铜反应生成硫酸镁和铜,镁片表面有红色物质析出,溶液逐渐变成无色,所以猜想③正确。故填:镁片表面有红色物质析出,溶液逐渐变成无色;③。
[交流与讨论]
(1)实验前所用的金属片都需用砂纸打磨,其目的是除去金属片表面的氧化膜或污物。故填:除去金属片表面的氧化膜或污物。
(2)实验4中反应的化学方程式为:Mg+CuSO4═MgSO4+Cu。故填:Mg+CuSO4═MgSO4+Cu。
(3)利用硫酸镁溶液、硫酸铜溶液和铬片可以判断三种金属活泼性,例如把铬片分别放入硫酸镁溶液、硫酸铜溶液中,放入硫酸镁溶液中的铬片无明显现象,说明镁比铬活泼,放入硫酸铜溶液中的铬片表面析出红色固体,说明铬比铜活泼;也可以利用硫酸亚铬溶液、镁片、铜片判断三种金属活泼性,例如把镁片、铜片分别伸入硫酸亚铬溶液,镁片表面析出银白色固体,说明镁比铬活泼,铜片表面无明显现象,说明铬比铜活泼。故填:①③⑥(或②⑤⑦)。

 阅读快车系列答案
阅读快车系列答案【题目】化学兴趣小组的同学想利用某矿石制备氢氧化镁,已知该矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,制备的流程如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。

请回答下列问题:
(1)溶液 A 中的阳离子除了 Mg2+、Fe3+、Cu2+外,还含有_____。写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:_____(只写一个)。
(2)在溶液 A 中加入熟石灰调节溶液的 pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关 pH 数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液 B 的 pH 的取值范围为_____。
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀时的 pH | 1.5 | 4.2 | 8.6 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液 B 中加入熟石灰发生的化学反应方程式:_____。
【题目】下表是元素周期表的一部分,试回答下列问题:
第一周期 | 1H | 2He | ||||||
第二周期 | 3Li | 4Be | 5B | 6C | ① | ② | 9F | 10Ne |
第三周期 | 11Na | 12Mg | ③ | 14Si | 15P | 16S | 17Cl | 18Ar |
(1)①所示元素是__________(填“金属元素”或“非金属元素”);
(2)②所示元素与③所示元素形成的化合物的化学式是_____;
(3)下图是某元素的原子结构示意图,该原子在化学反应中易__________电子;离子符号为____________ 。

(4)下图是某元素的原子结构示意图,该元素的原子核外电子数为____。