题目内容
【题目】厨房里有很多的化学物质,某同学对厨房的调味品进行了调查研究。
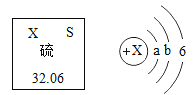
Ⅰ食盐是重要的调味品。缺碘会引起甲状腺肿大,如图是厨房中某“加碘盐”的标签,下列说法正确的是___________。

A碘盐中的“碘”指的是碘原子
B碘盐中含有钠原子、氯原子等微粒
C碘酸钾易溶水
D碘酸钾的化学性质很稳定
Ⅱ蔗糖也是常用的调味品。对蔗糖的制备及成分进行如下探究。
一、蔗糖的工业制备:工业制备蔗糖的流程如图所示。
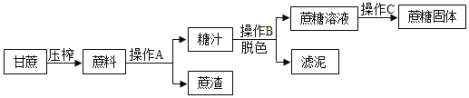
(1)糖汁呈棕黄色,工业上可加入___________(填一种化学物质)对糖汁进行脱色处理。
(2)由甘蔗制得蔗糖的整个过程中主要是___________(选填“物理”或“化学”)变化。
二、蔗糖组成探究
(资料卡片)
①绿色植物吸收空气中的CO2和H2O先合成葡萄糖,再将葡萄糖转化为蔗糖。
②蔗糖不易燃烧,掺入少量烟灰后,就能直接点燃(烟灰不能燃烧)。烟灰可能的作用为___________。
(成份探究)
实验操作 | 实验现象 | 实验结论 | |
实验1 | 点燃蔗糖与烟灰混合物,在火焰上方罩一干冷烧杯 | 烧杯壁有水雾 | 说明蔗糖中含有___________元素。 |
实验2 | 取下烧杯迅速加入澄清石灰水,振荡 | ___________ | 说明蔗糖中含有碳元素 |
实验3 | 取少量蔗糖隔绝空气高温加热 | 容器内壁出现水雾,生成黑色固体 | 说明蔗糖中还含有___________元素。 |
(计算验证)
已知:化学变化中,分子的种类发生改变,而原子的种类、个数和质量都不发生改变。现称取34.2g蔗糖,加入少量烟灰点燃,测得生成52.8g CO2和19.8g H2O。则34.2g蔗糖中,碳元素的质量为___________g,氢元素的质量为___________g。通过综合计算,可知蔗糖的化学式为___________(选填字母)。
AC6H5NO2 BC6H12O6 CC12H22 DC12H22O11
【答案】C 活性炭 物理 催化作用 氢 澄清石灰水变浑浊 氧 14.4 2.2 D
【解析】
Ⅰ.A、碘盐中的“碘”中的碘不是以单质、分子、原子等形式存在,这里所指的“碘”是强调存在的元素,与具体形态无关,故选项说法错误。
B、碘盐中含有氯化钠、碘酸钾,氯化钠是由钠离子和氯离子构成的,故选项说法错误。
C、加碘盐图中标签信息要:防潮,可知碘酸钾易溶水,故选项说法正确。
D、根据加碘盐图中标签信息,勿长时间炖炒、避光、避热等,可得碘酸钾的一种化学性质是:受热易分解或受热不稳定,故选项说法错误。
故选:C。
Ⅱ. (1)由于活性炭具有吸附性,糖汁呈棕黄色,工业上可加入活性炭对糖汁进行脱色处理;故填:活性炭;
(2)由甘蔗制得蔗糖的整个过程中没有新物质生成,主要是物理变化;故填:物理。
二、蔗糖组成探究
[资料卡片]
②蔗糖不易燃烧,掺入少量烟灰后,就能直接点燃(烟灰不能燃烧),说明烟灰加快了反应的速率,可能是作催化剂。故填:催化剂。
[成份探究]
实验1:点燃蔗糖与烟灰混合物,在火焰上方罩一干冷烧杯,烧杯壁有水雾,说明生成了水,水中含有氢、氧两种元素,根据质量守恒定律,反应前后,元素种类不变,反应物氧气中只含有氧元素,则蔗糖中一定含有氢元素,可能含有氧元素。
取下烧杯迅速加入澄清石灰水,石灰水变浑浊,说明生成了二氧化碳,同理,说明蔗糖中含有碳元素。
隔绝空气高温加热蔗糖,容器内壁也出现水雾,说明生成水,说明蔗糖中含有氢元素和氧元素。
故填:氢;石灰水变浑浊;氧。
[计算验证]
(3)52.8 g CO2中含有碳元素的质量为52.8g×![]() ×100%=14.4g;19.8gH2O中含氢元素的质量为19.8g×
×100%=14.4g;19.8gH2O中含氢元素的质量为19.8g×![]() ×100%=2.2g;氧元素的质量为34.2g-14.4g-2.2g=17.6g;
×100%=2.2g;氧元素的质量为34.2g-14.4g-2.2g=17.6g;
化合物原子的个数比=![]() ,则该物质分子中碳原子和氢原子的个数比为
,则该物质分子中碳原子和氢原子的个数比为![]() :
:![]() :
:![]() =12:22:11,则蔗糖的化学式为C12H22O11。
=12:22:11,则蔗糖的化学式为C12H22O11。
故填:14.4;2.2;D。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】铭铭在实验室做课外活动探究实验时,发现了一个非常奇怪的现象,当她把煤炭放在如图容器中燃烧时,发现紫红色的高锰酸钾溶液变成了无色。请你跟她一起探究原因。
(1)(提出问题)什么使紫红色的高锰酸钾溶液褪色的?
(2)(查阅资料)煤炭燃烧能够产生二氧化碳,而且煤炭中有硫元素,还会燃烧成二氧化硫气体。
(3)(猜想与假设)
a、甲同学假设_____。
b、乙同学假设_____。
(4)(实验与结论)两位同学为了验证自己的猜想,设计以下实验进行验证,请写出图中仪器A的名称_____

实验步骤 | 实验现象 | 实验结论 |
甲实验:取5mL稀高锰酸钾溶液于一支试管中,_____,观察现象。 | _____ | 甲同学假设不成立 |
乙实验:_____,并将二氧化硫气体通入试管中,观察现象 | _____ | 乙同学假设成立 |
【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究:

(集体讨论):
(1)小组同学共同设计了如图的两套装置,你认为合理的是_____(填字母)。
(2)为了确保实验成功,在装药品前应先_____。
(分组实验)在讨论的基础上,他们分组进行了实验.
(数据分析)实验结束后,整理数据如下:(注:集气瓶容积为100mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入瓶中体积水的体积 | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的_____。
(实验拓展)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体,如红磷。
(4)小红提出可以用细铁丝代替红磷,小雯不赞成,她的理由是_____。
(5)小刚选择镁条探究空气中氧气的含量,装置见下图,用砂纸打磨镁条的目的是_____。燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积_____%。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成推测减少的气体中有氮气。
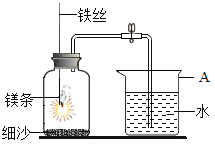
(发现问题)氮气是怎样减少的呢?
(假设一)氮气与镁条反应而减少。
(假设二)氮气与_____反应而减少。
(查阅资料)镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。该反应的符号表达式_____。
(反思总结)①测定空气中氧气含量不能选择镁带。
②物质燃烧_____(选填“一定”或“不一定”)需要氧气。
(计算拓展)①氮化镁中氮元素化合价为_____。
②试计算6g氮化镁中含多少质量的镁元素?_____