题目内容
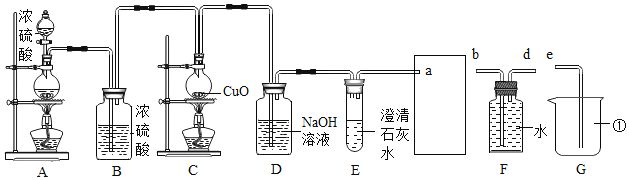
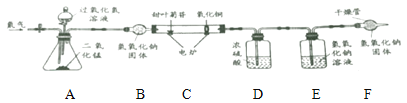
【题目】I.根据下列实验装置图,回答问题:
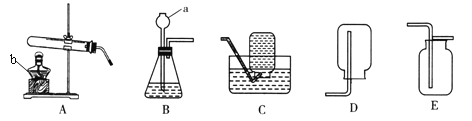
(1)实验仪器的名称:a_______________;b_________________。
(2)实验室用高锰酸钾制取氧气的化学方程式为:________________________________________,发生装置应该选用_______(填序号),该装置有一处不足,请改正:____________________________。要收集到较纯净的氧气,应该选用装置__________(填序号),若用该装置收集的氧气也不纯,原因可能是___________。
II.为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体,能与稀硫酸反应:CuO+H2SO4═CuSO4+H2O
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
(进行实验)
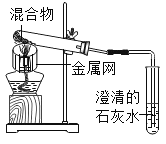
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1﹣1 | 1﹣2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
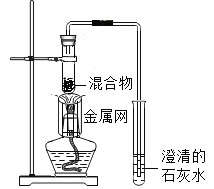
实验2:取一定量的混合物,用1﹣2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2﹣1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2﹣2 | 1:10 | 混有很少量黑色物质 | |
2﹣3 | 1:11 | 混有极少量黑色物质 | |
2﹣4 | 1:12 | 无黑色物质 | |
2﹣5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)若碳还原氧化铜得到的固体全部是铜,请写出化学反应方程式______________________。
(2)实验1﹣2中,证明生成CO2的现象是_________________________________________。
(3)实验1的目的是____________________________________________________________。
(4)实验2的结论是______________________________________。
(反思与评价)
(5)实验2没有进行质量比为1:14的实验,理由是________________________。
(6)如何检验2﹣4的红色固体中是否含Cu2O,请写出实验步骤、现象和结论 ________________________。
【答案】酒精灯 长颈漏斗 2KMnO4 ![]() K2MnO4 + MnO2+O2↑ A 在试管口处加一团棉花 C 没有等气泡连续均匀冒出时就开始收集气体 C + 2CuO
K2MnO4 + MnO2+O2↑ A 在试管口处加一团棉花 C 没有等气泡连续均匀冒出时就开始收集气体 C + 2CuO ![]() 2Cu+CO2↑ 试管内的澄清石灰水变浑浊 探究加热面积对碳还原氧化铜实验的影响 木炭粉与氧化铜反应的最佳质量比为1:12 因为质量比为1:14时氧化铜已经过量。 取少量的红色固体于试管中,加入足量的稀硫酸充分反应,若固体部分溶解,溶液变成蓝色,证明红色固体中含有Cu2O,否则没有
2Cu+CO2↑ 试管内的澄清石灰水变浑浊 探究加热面积对碳还原氧化铜实验的影响 木炭粉与氧化铜反应的最佳质量比为1:12 因为质量比为1:14时氧化铜已经过量。 取少量的红色固体于试管中,加入足量的稀硫酸充分反应,若固体部分溶解,溶液变成蓝色,证明红色固体中含有Cu2O,否则没有
【解析】
I.(1)仪器a的名称为酒精灯,仪器b的名称为长颈漏斗;
(2)实验室用高锰酸钾制取氧气的化学方程式为:2KMnO4 ![]() K2MnO4 + MnO2+O2↑;该反应为固固加热型,发生装置应该选用A;该装置的不足之处是没有在试管口处加一团棉花;要收集到较纯净的氧气,应用排水法收集氧气,应该选用装置C,若用该装置收集的氧气也不纯,原因可能是没有等气泡连续均匀冒出时就开始收集气体;
K2MnO4 + MnO2+O2↑;该反应为固固加热型,发生装置应该选用A;该装置的不足之处是没有在试管口处加一团棉花;要收集到较纯净的氧气,应用排水法收集氧气,应该选用装置C,若用该装置收集的氧气也不纯,原因可能是没有等气泡连续均匀冒出时就开始收集气体;
故填:2KMnO4 ![]() K2MnO4 + MnO2+O2↑;A;在试管口处加一团棉花;C;没有等气泡连续均匀冒出时就开始收集气体;
K2MnO4 + MnO2+O2↑;A;在试管口处加一团棉花;C;没有等气泡连续均匀冒出时就开始收集气体;
II.(1)若碳还原氧化铜得到的固体全部是铜,化学反应方程式为C + 2CuO ![]() 2Cu+CO2↑;
2Cu+CO2↑;
(2)实验1﹣2中,证明生成CO2的现象是试管内的澄清石灰水变浑浊;
(3)实验1的目的是探究加热面积对碳还原氧化铜实验的影响;
(4)实验2的是探究木炭粉与氧化铜的质量比对生成物的影响,结论是木炭粉与氧化铜反应的最佳质量比为1:12;
(5)根据方程式C + 2CuO ![]() 2Cu+CO2↑,反应物碳和氧化铜的质量比为12:160=3:40,实验2没有进行质量比为1:14的实验,理由是质量比为1:14时氧化铜已经过量;
2Cu+CO2↑,反应物碳和氧化铜的质量比为12:160=3:40,实验2没有进行质量比为1:14的实验,理由是质量比为1:14时氧化铜已经过量;
(6)取少量的红色固体于试管中,加入足量的稀硫酸充分反应,若固体部分溶解,溶液变成蓝色,证明红色固体中含有Cu2O,否则没有。