题目内容
【题目】近年,中美科学家合作从理论和实践上证实了全磷富勒烯B10的存在,成为烯实验和理论研究的新开端
(1薄膜状的全高勒烯具有重要应用前景。该材料属于_____________(填无机材料”或“合成材料”)
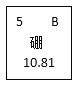
(2)在元素周期表中相关信息如图所示。下列说法正确的是______。
A 原子核内有5个质子
B 属于金属元素
C 的相对原子质量为10.81g
(3)单质可以通过镁矿Mg2B2O5来制取,制取过程的一步反应为加热条件下氧化硼与镁发生置换反应,得到单质和另一种氧化物,氧化硼和镁矿Mg2B2O5中硼元素的化合价相同。
①镁矿Mg2B2O5中硼元素的化合价为_________。
②氧化硼与镁发生置换反应的化学方程式为__________________________。
【答案】无机材料 A +3 ![]()
【解析】
(1)全高勒烯不含碳元素,属于无机材料;
(2)A、硼的原子序数为5,由原子序数=质子数,硼原子核内有5个质子,正确;
B、硼元素的偏旁是“石”,属于非金属元素,错误;
C、相对原子质量的单位为“1”,一般不写,硼原子的对原子质量为10.81,故错误;
故选A。
(3)①Mg2B2O5中镁元素显+2价,氧元素显-2价,设硼元素的化合价为x,根据化合物中元素化合价代数和为0,则(+2)×2+2x+(-2)×5=0,得x=+3,故填:+3;
②加热条件下氧化硼与镁发生置换反应,得到硼和氧化镁,反应的化学方程式为:![]() ,故填;
,故填; ![]() 。
。

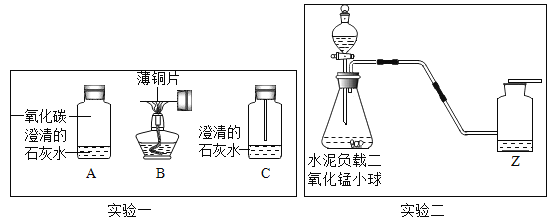
【题目】I.根据下列实验装置图,回答问题:
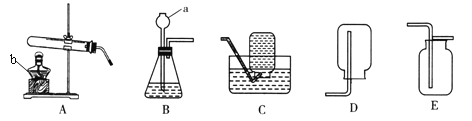
(1)实验仪器的名称:a_______________;b_________________。
(2)实验室用高锰酸钾制取氧气的化学方程式为:________________________________________,发生装置应该选用_______(填序号),该装置有一处不足,请改正:____________________________。要收集到较纯净的氧气,应该选用装置__________(填序号),若用该装置收集的氧气也不纯,原因可能是___________。
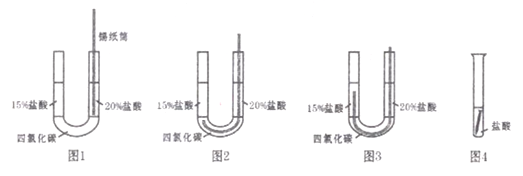
II.为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体,能与稀硫酸反应:CuO+H2SO4═CuSO4+H2O
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1﹣1 | 1﹣2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
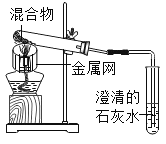
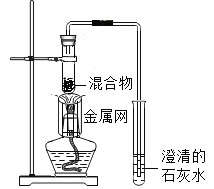
实验2:取一定量的混合物,用1﹣2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2﹣1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2﹣2 | 1:10 | 混有很少量黑色物质 | |
2﹣3 | 1:11 | 混有极少量黑色物质 | |
2﹣4 | 1:12 | 无黑色物质 | |
2﹣5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)若碳还原氧化铜得到的固体全部是铜,请写出化学反应方程式______________________。
(2)实验1﹣2中,证明生成CO2的现象是_________________________________________。
(3)实验1的目的是____________________________________________________________。
(4)实验2的结论是______________________________________。
(反思与评价)
(5)实验2没有进行质量比为1:14的实验,理由是________________________。
(6)如何检验2﹣4的红色固体中是否含Cu2O,请写出实验步骤、现象和结论 ________________________。