��Ŀ����
����Ŀ��ʵ���ҳ��ü��ᣨH2CO2����Ũ�����ϼ����Ʊ�һ����̼����Ӧ����ʽΪH2CO2![]() H2O+CO��������һ����̼��ԭ����ͭ����Ӧ����ʽΪCO+CuO
H2O+CO��������һ����̼��ԭ����ͭ����Ӧ����ʽΪCO+CuO![]() Cu+CO2����ʵ��װ����ͼ��ʾ����ش�
Cu+CO2����ʵ��װ����ͼ��ʾ����ش�
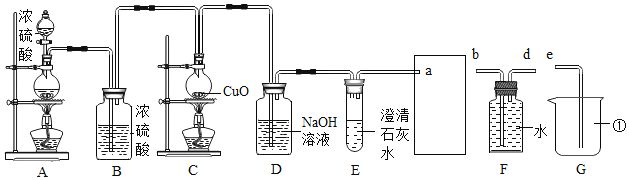
��1��װ��G������������_____��װ��B��������_____��
��2��װ��E����������װ��D���ն�����̼�Ƿ���ȫ����װ��_____����ܡ����ܡ��ﵽĿ�ģ�д��D �еĻ�ѧ��Ӧ����ʽ��_____��
��3��Ϊ����һ����̼��Ⱦ��������������һ����̼��������Ӧ����װ��F��G�����ܽӿڵ�˳��Ϊa��_____��_____��e��
��4����Ӧ�����У�װ��C����ƿ������ͭ��ĩ���ڡ����ڡ�״̬��һ����̼����������£�������������_____����ƿ�ڹ������ʵ���ɫ�仯��_____��
���𰸡��ձ� ��ȥһ����̼�е�ˮ���� ���� 2NaOH+CO2��Na2CO3+H2O d b ��������ͭ�Ӵ���� ��ɫ��Ϊ��ɫ
��������
��1��װ��G�Т����ձ���Ũ���������ˮ�ԣ����Գ�ȥһ����̼�е�ˮ������
��2���ó����ʯ��ˮ�����������̼�Ƿ��������Ҫ������ͨ��ʯ��ˮ�У���������Ӧ����Һ�����£�����ͼʾװ�ò��ܴﵽĿ�ģ�������̼���������Ʒ�Ӧ����̼���ƺ�ˮ��Ӧ�Ļ�ѧ����ʽ�ǣ�2NaOH+CO2��Na2CO3+H2O��
��3��Ϊ���⽫CO�ŷŵ������У�����������CO������Cװ�����ռ�������̼��һ����̼������ˮ���������dz�ˮ�ܣ��ܽӿڵ�����˳��ӦΪa��d��b��e��
��4��װ��C����ƿ������ͭ��ĩ���ڡ����ڡ�״̬����������������ͭ��ĩ��һ����̼����ĽӴ��������Ӧ����֣��ڼ��ȵ������£�һ����̼�ܽ���ɫ������ͭ��ԭΪ��ɫ��ͭ��

 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�����Ŀ��ʵ���ҳ���˫��ˮ��������̻������ȡ������д����ط�Ӧ�Ļ�ѧ����ʽ��___��С��ͬѧ����˫��ˮ�ֽ������Ӱ��������������̽����
��������⣩Ӱ��˫��ˮ�ֽ��������������Щ��
����������裩����һ��������������̵���״�йأ�������������뷴Ӧ�¶��йء�
����Ʋ�ʵ�飩С��ͬѧ��8ml3%��˫��ˮ�Ͷ������̽���������ʵ��(��Ӧ����10sʱ��H2O2����ʣ��)��
ʵ���� | �¶�/�� | �������̵���״(��ȡ0.1g) | �ռ������������/ml(ʱ���Ϊ10s) |
�� | 20 | ��״ | a |
�� | 20 | ��ĩ״ | b |
�� | 20 | ��״ | c |
�� | 20 | ��ĩ״ | d |
(1)��̽���¶ȶ���˫��ˮ�ֽ�������Ƿ���Ӱ�죬Ӧ�ñȽ�___��___(����a����b����c������d��)�Ĵ�С������ĩ״�������̴�Ч���ã���ô___��___(����a����b����c������d��)��
(2)����������ͬ��˫��ˮŨ�ȿ��ܻ�Ӱ���Ч�����������ʵ�鷽��������֤��___��
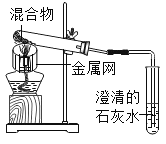
(3)С��ͬѧ��ʹ����ѹǿ�������ⲻͬ�����������̶�˫��ˮ�ֽ������Ӱ�죬����8mL 3%��˫��ˮ�зֱ������0.03g��0.06g��0.08g��0.12g��0.24gMnO2�����������ѹǿ�ı仯������ͼ��ʾ(���ߵ�б�ʴ���������Ӧ������)������۲�ͼʾ��д�����������Խ��ۣ�
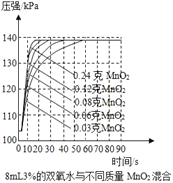
��___��
��___��
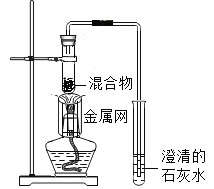
����Ŀ��I����������ʵ��װ��ͼ���ش����⣺
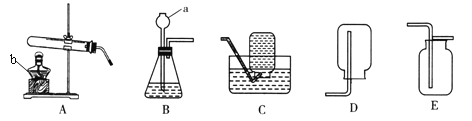
��1��ʵ�����������ƣ�a_______________��b_________________��
��2��ʵ�����ø��������ȡ�����Ļ�ѧ����ʽΪ��________________________________________������װ��Ӧ��ѡ��_______������ţ�����װ����һ�����㣬�������____________________________��Ҫ�ռ����ϴ�����������Ӧ��ѡ��װ��__________������ţ������ø�װ���ռ�������Ҳ������ԭ�������___________��
II��Ϊ̽��̼��ԭ����ͭ�����ʵ����������ľ̿�ۺ�����ͭ�ĸ�������1��2.5g����ϵ��ʵ�顣
���������ϣ�������ͭ��CuO��Ϊ��ɫ���壬����ϡ���ᷴӦ��CuO+H2SO4�TCuSO4+H2O
��̼��ԭ����ͭ�õ���ͭ�п��ܺ���������������ͭ��������ͭΪ��ɫ���壬����ϡ���ᷴӦ��Cu2O+H2SO4�TCuSO4+H2O+Cu��
������ʵ�飩
ʵ��1��ȡ������1��11��ľ̿�ۺ�����ͭ�����1.3g������ʵ�顣
��� | 1��1 | 1��2 |
װ�� |
|
|
��Ӧ�����ʵ���ɫ��״̬ | ��ɫ��ĩ�л���������ɫ���� | ��ɫ�����н��������м�������ɫ���� |
ʵ��2��ȡһ�����Ļ�����1��2װ�ý���ʵ�顣
��� | ľ̿��������ͭ�������� | ��Ӧ�����ʵ���ɫ��״̬ | |
2��1 | 1��9 | ��ɫ�����н������� | ����������ɫ���� |
2��2 | 1��10 | ���к�������ɫ���� | |
2��3 | 1��11 | ���м�������ɫ���� | |
2��4 | 1��12 | ��ɫ���� | |
2��5 | 1��13 | ���н϶��ɫ���� | |
����������ۣ�
��1����̼��ԭ����ͭ�õ��Ĺ���ȫ����ͭ����д����ѧ��Ӧ����ʽ______________________��
��2��ʵ��1��2�У�֤������CO2��������_________________________________________��
��3��ʵ��1��Ŀ����____________________________________________________________��
��4��ʵ��2�Ľ�����______________________________________��
����˼�����ۣ�
��5��ʵ��2û�н���������Ϊ1��14��ʵ�飬������________________________��
��6����μ���2��4�ĺ�ɫ�������Ƿ�Cu2O����д��ʵ�鲽�衢����ͽ��� ________________________��