题目内容
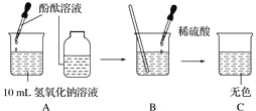
【题目】下列如图所示图象中有关量的变化趋势与对应叙述关系正确的是( )
A. 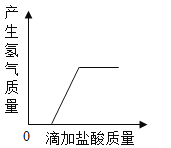 向一定质量的打磨光亮的锌片中滴加盐酸
向一定质量的打磨光亮的锌片中滴加盐酸
B. 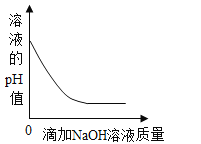 向一定质量的稀硫酸中滴加氢氧化钠溶液
向一定质量的稀硫酸中滴加氢氧化钠溶液
C. 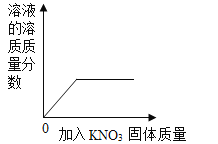 一定温度下向一定量水中加入KNO3固体
一定温度下向一定量水中加入KNO3固体
D. 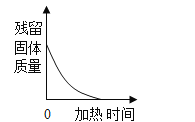 加热一定质量的高锰酸钾制取氧气
加热一定质量的高锰酸钾制取氧气
【答案】C
【解析】
A、向一定质量的打磨光亮的锌片中滴加盐酸,锌与稀盐酸反应生成氯化锌和氢气,一开始就产生氢气,故选项图象错误。
B、向一定质量的稀硫酸中滴加氢氧化钠溶液,酸性逐渐减弱,至完全反应,溶液显中性,继续滴加氢氧化钠溶液,溶液显碱性,pH值的变化是从小于7逐渐的增大到大于7,故选项图象错误。
C、一定温度下向一定量水中加入KNO3固体,至饱和,不再继续溶解,溶质质量分数逐渐增大,至饱和不再发生改变,故选项图象正确。
D、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,剩余固体的质量减少,但不可能减少至0,故选项图象错误。
故选:C。

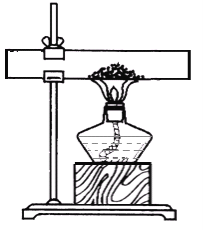
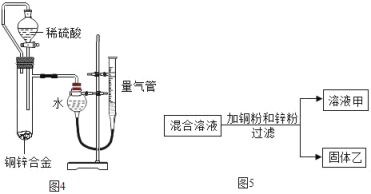
【题目】小君和小英同学发现:带火星的竹签在空气中不会复燃,若用装有60%水的集气瓶倒置在水槽中收集氧气,得到的气体能使带火星的竹签复燃,为了找到能使带火星竹签复燃的氧气含量最小值,他们进行了如下探究:
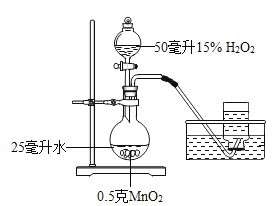
(设计实验)小君设计了如图的装置,该装置的圆底烧瓶中放入25毫升水的目的是____________。
(实验研究)第一组实验:取3只集气瓶,编号为①②③,分别装入15%30%和45%的水,盖上盖玻片倒置在水槽中。当气泡___________________放出后,导管口伸入集气瓶把其中的水全部排出,将相同的3支带火星竹签分别插入①~③号瓶中,记录实验现象。
获得第一组实验现象后,小君又做了第二组实验,并记录实验现象,两组实验数据和现象见下表:
实验分组 | 第一组 | 第二组 | ||||
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
集气瓶装水的体积分数/% | 15 | 30 | 45 | 34 | 38 | 42 |
带火星竹签状况 | 亮 | 很亮 | 复燃 | 很亮 | 复燃 | 复燃 |
得出上述两组实验现象后,小英认为还不能确定能使带火星竹签复燃的氧气含量最小值,需继续进行实验。则实验序号⑦的集气瓶装水的体积分数应该是_________%。
(实验结论)再经过数次实验并计算后得出:能使带火星竹签复燃的氧气含量最小值为48.7%。
(继续探究)小君认为采用该方法收集的氧气中含有一定量的水蒸气,请你提出实验改进的措施______________________。
【题目】化学兴趣小组对“蜡烛及其燃烧”进行探究。
(查阅资料)蜡烛的主要成分是石蜡,石蜡由碳、氢两种元素组成。
问题一:蜡烛燃烧的产物是什么?
问题二:燃着的蜡烛在密闭容器中熄灭的原因是什么?
(作出猜想)问题一:蜡烛燃烧的产物含有二氧化碳和水;除了上述猜想,你的猜想:燃烧产物可能还含有_____。
问题二:熄灭的原因是燃烧消耗完了氧气;熄灭的原因是二氧化碳含量增多。
(实验1)(1)用冷而干的小烧杯罩在蜡烛火焰上,观察到_____,证明有水生成。
(2)用内壁涂有澄清石灰水的小烧杯罩在蜡烛火焰上,观察到_____证明有二氧化碳生成。二氧化碳和石灰水反应的化学方程式为_____。
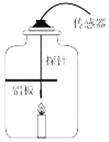
(实验2)在老师的帮助下,在如图所示装置中,点燃蜡烛至熄灭,利用多功能传感器测量了有关量。实验结束后,发现黑色固体颗粒附着在铝板表面,同时传感器获得的实验前后有关数据如表所示:
相对湿度 | 氧气含量 | 二氧化碳含量 | 一氧化碳含量 | |
蜡烛点燃前 | 36.4% | 21.2% | 0.058% | 0 |
蜡烛熄灭后 | 72.6% | 15.6% | 3.843% | 0.0192% |
(实验结论)由实验及结果,蜡烛燃烧生成的产物是_____;密闭容器内蜡烛熄灭的原因是_____。
(反思拓展)含碳燃料不充分燃烧会生成一氧化碳等物质,既浪费资源,又污染空气。为使燃料充分燃烧,应采取的措施是_____(答一条即可)。
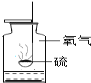
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氧气 |
解释 | 集气瓶中的水: 吸收放出的热量 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落熔融物,防止集气瓶炸裂 | 集气瓶中的水: 排出瓶内的空气 |
A. AB. BC. CD. D