题目内容
【题目】(1)酒中所含酒精的化学名称是乙醇,乙醇被广泛应用于生产新型环保燃料乙醇汽油,乙醇汽油在一定程度上能够缓解能源危机,乙醇汽油属于_____(填“纯净物”或“混合物”)。
(2)乙醇是一种无色具有醇香味的液体,易溶于水,易燃烧,是一种常用的有机溶剂,也是一种常用的燃料。以上描述中,属于化学性质的是_____。
(3)乙醇燃烧能够释放大量热量,是一种优质能源,乙醇燃烧的化学方程式为_____。
(4)已知某酒精(C2H5OH)溶液中,氢元素的质量分数为12%,则该溶液中溶质的质量分数为_____。
A 25% B 46% C 54% D 75%
【答案】混合物 易燃烧 C2H5OH+3O2![]() 2CO2+3H2O B
2CO2+3H2O B
【解析】
(1)乙醇汽油是由多种物质组成的,属于混合物;故填:混合物;
(2)易燃烧需要发生化学变化才能表现出来,属于化学性质;故填:易燃烧;
(3)乙醇燃烧生成水和二氧化碳,反应的化学方程式为:C2H5OH+3O2![]() 2CO2+3H2O;故填:C2H5OH+3O2
2CO2+3H2O;故填:C2H5OH+3O2![]() 2CO2+3H2O;
2CO2+3H2O;
(4)酒精溶液中设酒精的质量为x,水的质量为y,则
酒精中H元素的质量为:x×![]() =
=![]()
水中H元素的质量为:y×![]() =
=![]()
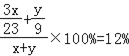
x=![]()
则该溶液中溶质的质量分数为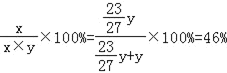
故选:B。

练习册系列答案
相关题目