题目内容
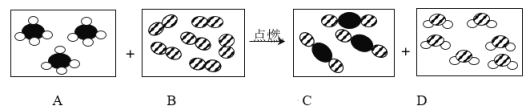
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
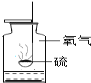
硫在氧气中燃烧 |
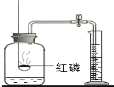
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氧气 |
解释 | 集气瓶中的水: 吸收放出的热量 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落熔融物,防止集气瓶炸裂 | 集气瓶中的水: 排出瓶内的空气 |
A. AB. BC. CD. D
【答案】A
【解析】
A、硫在氧气中燃烧生成二氧化硫,集气瓶中水的主要作用是吸收反应生成的二氧化硫,以防止二氧化硫污染环境,该选项解释没有体现水的主要作用;
B、红磷在空气中燃烧生成五氧化二磷,通过进入集气瓶中的水的体积可以判断空气中氧气的含量,量筒中的水的主要作用是通过水体积的变化得出氧气的体积,该选项解释体现了水的主要作用;
C、铁在氧气中燃烧时容易形成高温熔融物,并且高温熔融物容易溅落,集气瓶中的水的主要作用是冷却溅落融熔物,防止集气瓶炸裂,该选项解释体现了水的主要作用;
D、利用排水法收集氢气,开始时装满水是排出集气瓶中的空气,后来是利用排出的水确定什么时间收集满氢气,故D体现了水的主要作用;
故选:A。

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
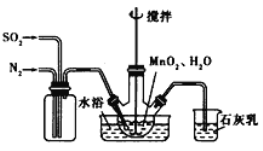
黄冈360度定制密卷系列答案【题目】下水道堵塞是日常生活中经常遇到的问题,下水管里的淤积物主要为油污、食物残渣、毛发等。“管道通”可使堵塞的管道畅通无阻。化学兴趣小组对“管道通”中的物质进行了探究:

(查阅资料)
(1)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
(2)铝粉呈银白色。铝粉与强酸、强碱溶液都能迅速反应放出氢气,同时放出大量热。
①铝与盐酸反应的化学方程式为_____。
②铝与氢氧化钠溶液反应的化学方程式为_____=2NaAlO2+3H2↑
(1)(猜想与验证)打开一盒“管道通”,内有一袋白色固体颗粒和一袋银白色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
实验操作 | 实验现象 |
①将几粒白色颗粒放在表面皿上,露置在空气中片刻。 | _____ |
②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 | 试管外壁温度升高 |
③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 | 羊毛线缩小 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银白色粉末为铝粉。
实验操作 | 实验现象 |
①取少量该粉末于洁净的试管中,滴加稀盐酸,用手触摸 试管外壁,点燃反应产生的气体 | 产生大量气泡,试管外壁温度明显升高,气体燃烧产生淡蓝色火焰。 |
②取少量该粉末于洁净的试管中,滴加_____,用手触摸 试管外壁,点燃反应产生的气体 |
结论:银白色粉末为铝粉。
(应用)
(2)使用“管道通”时,先将银白色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口。管道内可能出现的现象是_____.(填序号)
A.管道内温度明显升高
B.产生大量气体
C.管道被疏通
(3)“管道通”内的两种物质必须密封保存,否则会发生变质。用化学方程式表示其中的原因:_____、_____。