题目内容
【题目】某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气.根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐.
(猜想与假设)
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解。
乙同学:铁钉里的________加快了H2O2的溶液分解。
(设计方案和实验) 完成下列表:________、________、________
(反思与评价) 丁同学仔细观察“方案二”中一直没有现象的试管,过了一段时间后发现试管中也产生了气体,丁同学对此现象进行深入思考和分析,得出可能的原因,你能想出其中的原因吗?____________
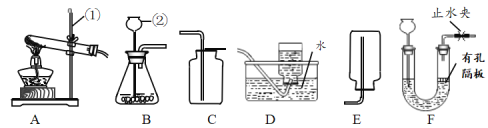
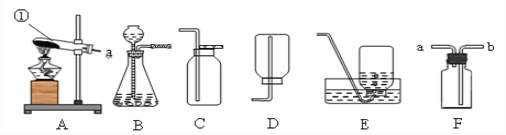
某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图所示,夹持仪器已略去)

(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
(实验记录)同学们进行6组实验,实验记录如下:

(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是______mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定______来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是_____(填序号)。
(4)通过实验①、②、④可得出的结论是______。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是______ ,______请写出⑥的符号表达式____________
(6)某同学改用如图所示装置代替气囊完成实验②,正确的实验操作顺序是______。

a.将导管伸入量筒,开启控温加热器,滴入过氧化氢溶液b.开启控温加热器,将导管伸入量筒,滴入过氧化氢溶液c.开启控温加热器,滴入过氧化氢溶液,待导管口有连续均匀气泡冒出时将导管伸入量筒。
【答案】铁(Fe) 有大量气泡产生,带火星木条复燃 2g铁(Fe ) 不成立 可能是铁被过氧化氢溶液氧化成氧化铁,后来氧化铁催化过氧化氢溶液 6 通过测定产生相同体积的氧气所需的时间或相同时间内产生氧气的体积。 ③④ 温度越高,过氧化氢分解速率越大,; 相同时间内实验产生氧气少 需要加热;水蒸气含量高(答两点)。 2H2O2 ![]() 2H2O+O2↑ a
2H2O+O2↑ a
【解析】
猜想与假设:根据题中所给的信息进行分析;
设计方案和实验:根据题中的实验现象结合猜想与假设进行分析;
反思与评价:根据氧化铁能做过氧化氢溶液的催化剂,而铁单质不能做其反应的催化剂进行分析;
解释与结论:(1)根据对照实验的唯一性分析;
(2)根据反应速率的测定方式分析;
(3)过氧化氢溶液的浓度越大分解速率越大,所以实验的变量为过氧化氢溶液的浓度;
(4)①、②、④的变量为水槽中水的温度;
(5)根据反应的速率分析;
(6)根据气体的制取和收集分析。
猜想与假设:生锈铁钉的组成主要是:氧化铁和铁,甲同学猜想:铁钉表面的氧化铁加快了H2O2的溶液分解,实验乙同学:铁钉里的铁加快了H2O2的溶液分解;
设计方案和实验:方案一:若甲同学结论成立,铁钉表面的氧化铁加快了H2O2的溶液分解,所以实验现象为有大量气泡产生,带火星木条复燃;
方案二:根据乙同学的猜想可知,应向盛有10mL5%H2O2溶液的试管中加入2g铁粉,没有现象说明乙同学结论不成立;
反思与评价:可能是铁被过氧化氢溶液氧化成氧化铁,后来氧化铁催化过氧化氢溶液,所以丁同学仔细观察“方案二”中一直没有现象的试管,过了一段时间后发现试管中也产生了气体;
解释与结论:(1)实验研究影响过氧化氢分解速率的因素温度、溶液的浓度、催化剂种类。通过60min产生氧气体积,比较反应速率,所以要保证过氧化氢溶液的体积相同,所以x=6;
(2)比较过氧化氢的分解速率可通过相同时间内产生氧气的体积或产生相同体积的氧气所需的时间,进行比较;
(3)过氧化氢溶液的浓度越大分解速率越大,所以实验的变量为:过氧化氢溶液的浓度,所以可通过③④进行对比;
(4)①、②、④的变量为水槽中水的温度,并且发现温度越高,过氧化氢分解速率越大;
(5)相同时间内实验②产生氧气少,速率太慢并且由于需要加热,水蒸气含量高,⑥的符号表达式为2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(6)由于要测定产生气体的体积,需要实验一开始就收集,所以要将导管伸入量筒,开启控温加热器,滴入过氧化氢溶液,保证气体都收集起来。故选a。