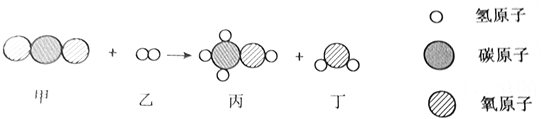
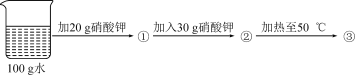题目内容
【题目】①在点燃氢气以前,一定要先______________________,以防爆炸。
②在制取氧气时,连接好装置后,加药品以前,一定要_______________________
③城市中的生活用水是经自来水厂净化处理过的,其过程可表示为:取水→沉降→过滤→吸附→消毒→配水。在净化天然水的步骤中,属于化学变化的是____________小明在过虑河水时发现滤液仍然浑浊,请分析两条可能的原因_____________、_____________________
④镁条在空气中燃烧的实验中,每6份质量的镁在_______份的氧气中燃烧,完全反应生成____份质量的氧化镁。发生反应的化学方程式是_______________________________
【答案】检验气体的纯度 检查装置的气密性 消毒 滤纸可能破损 滤液的液面高于滤纸的边缘 4 10 2Mg+O2![]() 2MgO
2MgO
【解析】
①可燃性气体不纯遇明火可能会发生爆炸,所以点燃可燃性气体之前一定要检验纯度;
②制取气体时,应先检查装置的气密性,后装入药品;
③取水,一般是用水泵将河水输送至水厂,没有生成其他物质,属于物理变化;过滤,能将难溶的固体物质除去,没有生成其他物质;吸附,常用的吸附剂是活性炭,能吸附有色有异味的物质,没有生成其他物质;消毒,一般消毒剂能破坏细菌中的物质,从而使细菌失去活性,在该过程中生成了其他物质,是化学变化;滤纸破损,则混合物就会不经过滤直接进入滤液;待滤液体液面高于滤纸边缘,液态混合物也会从过滤器外侧流下;接滤液的烧杯不干净,滤液也会浑浊;
④镁在空气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O2![]() 2MgO;该反应中,在此反应中镁、氧气和氧化镁的质量关系48:32:80,则6份质量的镁与4份质量的氧气化合生成10份质量的氧化镁。
2MgO;该反应中,在此反应中镁、氧气和氧化镁的质量关系48:32:80,则6份质量的镁与4份质量的氧气化合生成10份质量的氧化镁。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】质量守恒定律对科学发展具有重大意义。
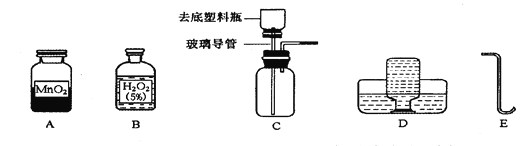
Ⅰ.用如图所示的 3 个实验装置进行验证质量守恒定律的实验,其中不能达到实验目的是_____(填序号),其原因是_____。

Ⅱ.A 图是测定红磷燃烧前后质量的变化情况,用来验证质量守恒的实验,试回答:
(1)红磷燃烧的化学方程式是_____。
(2)在这个实验中气球的作用是_____。
(3)将橡皮塞上的玻璃管放在酒精灯上灼烧到红热后,迅速用橡皮塞将锥形瓶塞紧,并将红磷引燃,这里要“迅速用橡皮塞将锥形瓶塞紧”的原因是_____。
Ⅲ.C 中反应的化学方程式是_____。
Ⅳ.在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表。已知甲的相对分子质量为丁的 2 倍,则下列说法不正确的_____。
甲的质量/g | 乙的质量/g | 丙的质量/g | 丁的质量/g | |
反应前 | 64 | 10 | 1 | 16 |
t 时刻 | 32 | a | ||
反应后 | 0 | 42 | b | 48 |
A.该反应的基本类型是分解反应 B.a 等于 32
C.丙可能是催化剂 D.该反应方程式中甲与丁的化学计量数之比为 2:1