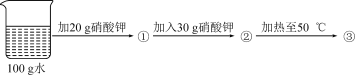题目内容
【题目】用化学用语填空:
①4个氢原子______;②3个亚铁离子______;③五氧化二磷中磷元素的化合价_______;
【答案】4H ![]()
![]()
【解析】
本题考查了常见了化学用语的书写,书写时注意规范。
①原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,在其元素符号前加上相应的数字,4个氢原子表示为4H;
②离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。表示多个该离子,就在其离子符号前加上相应的数字,故3个亚铁离子可表示为3Fe2+;
③元素化合价的表示方法是确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后。在五氧化二磷中氧元素显-2价,根据化合物中各元素的化合价为零,五氧化二磷中磷元素的化合价为+5,可表示为![]() 。
。

练习册系列答案
相关题目
【题目】根据下表回答问题
实验内容 | 加热液体药品 | 加入粉末药品 | 称量固体氢氧化钠 |
实验操作图 |
|
|
|
编号 | A | B | C |
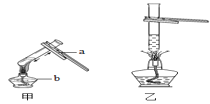
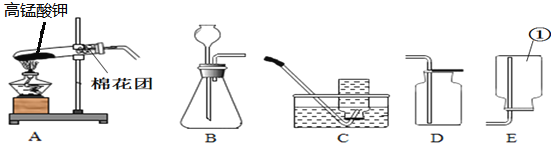
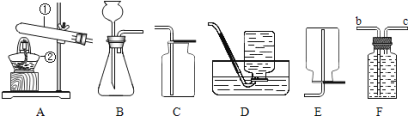
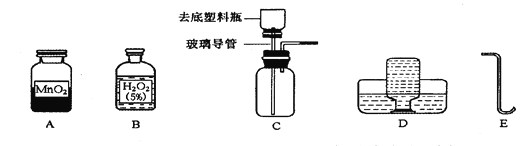
(1)A实验给试管中的液体加热时,通常采用图甲的加热方法,即将试管倾斜成大约45度角,其原因是________。
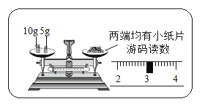
(2)图丙或图丁向试管中加入粉末状固体时,用长柄药匙或纸槽送至试管底部,原因是___________。
(3)C实验,氢氧化钠具有强烈的腐蚀性,图中的错误是______和_________,该实验称取的氢氧化钠的实际质量为_________g。