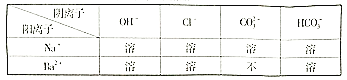
题目内容
【题目】怀化市城区在2018年1月投放了大量的“共享单车”(如图所示),极大地缓解城市交通压力,减少大气污染,方便市民绿色出行,

(1)“共享单车”的部件中用到的合成材料有__________________________(填图中的序号);
(2)“共享单车”常年露天放置,其中钢铁制造的部件与空气中氧气和_______等发生化学反应而生锈,为防止钢铁生锈。常采用_________________________方法(答一点即可)。
(3)“共享单车”所使用的钢铁来自工业炼铁,其反应的原理是____________________(有化学方程式表示)。
【答案】 ①④ 水(或水蒸气); 涂油、刷漆、镀金属、制成合金和保持表面洁净干燥等(合理答案都计分) Fe2O3+3CO![]() 2Fe+3CO2 或Fe3O4+4CO
2Fe+3CO2 或Fe3O4+4CO![]() 3Fe+4CO2或FeO+CO
3Fe+4CO2或FeO+CO![]() Fe+CO2 或2Fe2O3+3C
Fe+CO2 或2Fe2O3+3C![]() 4Fe+3CO2↑等(合理答案均给分)
4Fe+3CO2↑等(合理答案均给分)
【解析】
(1)图中橡胶轮胎和手柄是合成材料,故选①④;
(2)铁生锈的条件是与空气的中的水和氧气接触反应;防止生锈的方法有涂油、涂漆、电镀等;
(3)工业炼铁是用一氧化碳还原氧化铁,一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,反应方程式为Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。

【题目】实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告:
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
【进行实验】选择如下图所示装置进行验证:
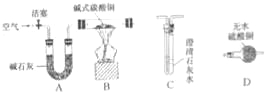
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→ → (填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式 ;
②写出Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。
【题目】某课外兴趣小组为了测定当地石灰石中CaCO3的质量分数,取25g石灰石样品,粉碎后,将100g一定质量分数的稀盐酸分5次加入到该样品中,所测数据如下表所示(杂质不与稀盐酸反应,也不溶于水):
次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
产生气体的质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
(1)生成CO2的质量为_________g;
(2)第__________次恰好完全反应;
(3)求石灰石样品中CaCO3的质量分数。_________
【题目】下面呈现的是某实验小组在课堂上做的一组探究实验:
(1)在a试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到的现象是_____。
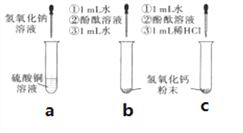
(2)向b、c两支试管中各加入少量相同质量的氢氧化钙粉末,然后各加入1mL水,振荡,呈浑浊状,静置,再各滴入1~2 滴酚酞溶液,观察到两试管溶液均变红。继续向b试管中加入约1mL水振荡;向c试管中加入约1mL稀盐酸,振荡。发现b试管变澄清,溶液仍呈红色,c试管变澄清,溶液变成无色。向b试管中第二次加入约1mL水的作用是________。
(提出问题)试管c中加入约1mL稀盐酸后,溶液中的溶质是什么?
(查阅资料)查阅资料:CaCl2溶液呈中性。
(猜想假设)小丽猜想:I.CaCl2 Ⅱ.CaCl2和HCl Ⅲ.CaCl2和Ca(OH)2
(反思质疑)小明对猜想Ⅲ产生质疑,理由是___________
(进行实验)小组同学通过交流,设计如下实验方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
取少量c试管中的溶液于试管中,_______ | ________ | 猜想Ⅱ成立 |
实验结束,小组同学将a、b、c三支试管中的剩余物质混合,发现废液呈浑浊。
(问题与交流)废液中大量存在的阳离子有_______。写出废液中可能发生反应的一个化学方程式________。
【题目】如表是 NaCl、NH4Cl 在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
(1)以上两种物质的溶解度受温度影响较大的是_____。
(2)40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,所得溶液的质量为_____g。
(3)20℃时,NaCl 饱和溶液的溶质质量分数为(精确到小数点后 1 位)_____。