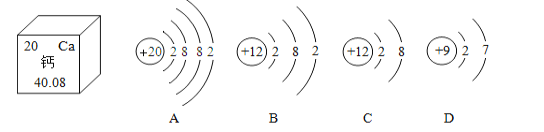
题目内容
【题目】利用某工业废弃固体(成分为Cu2S和FeS2)制备硫酸铜溶液和硫酸亚铁晶体,流程如图所示。
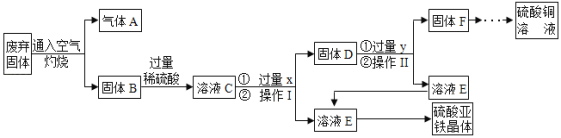
(已知:①固体B含有氧化铜、氧化铁②铁能与硫酸铁反应,生成硫酸亚铁)
(1)操作I是_____。为了提高废弃固体的反应速率,除将固体粉碎、提高温度外,还可以采取的具体措施有_____(写一条)。
(2)写出FeS2在空气中灼烧的化学方程式_____。
(3)溶液C中的溶质有_____(用化学式表示)。
(4)试剂y的作用是_____。
【答案】 过滤 通入足量的氧气; 4FeS2+11O2![]() 2Fe2O3+8SO2; H2SO4、CuSO4、Fe2(SO4)3; 将铁、铜分离出来。
2Fe2O3+8SO2; H2SO4、CuSO4、Fe2(SO4)3; 将铁、铜分离出来。
【解析】
根据流程图可知固体B中含有氧化铜和氧化铁,加入过量的稀硫酸之后,反应生成硫酸铜和硫酸铁,所以溶液C中的溶质有硫酸铜、硫酸铜和过量的硫酸,溶液C中加入过量的金属铁,铁和硫酸铜反应生成铜和硫酸亚铁,铁和硫酸铁反应生成硫酸亚铁,铁和硫酸反应生成硫酸亚铁和氢气,所以固体D是铁和铜,溶液E中的溶质是硫酸亚铁,向固体D中加入过量的稀硫酸,反应生成硫酸亚铁和氢气。
(1)过滤可以将不溶性固体从溶液中分离出来,所以操作I是过滤,为了提高废弃固体的反应速率,除将固体粉碎、提高温度外,还可以采取的具体措施有通入足量的氧气;(2)二硫化亚铁和氧气在点燃的条件下生成氧化铁和二氧化硫,化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2 ;(3)固体B含有氧化铜、氧化铁,氧化铁和硫酸反应生成硫酸铁,氧化铜和硫酸反应生成硫酸铜,所以溶液C中的溶质有:H2SO4、CuSO4、Fe2(SO4)3;(4)铁能与硫酸铁反应,生成硫酸亚铁,铁和硫酸铜反应生成硫酸亚铁和铜,所以固体D中含有铁和铜,加入y后得到硫酸亚铁溶液和铜,所以试剂y的作用是:将铁、铜分离出来。
2Fe2O3+8SO2 ;(3)固体B含有氧化铜、氧化铁,氧化铁和硫酸反应生成硫酸铁,氧化铜和硫酸反应生成硫酸铜,所以溶液C中的溶质有:H2SO4、CuSO4、Fe2(SO4)3;(4)铁能与硫酸铁反应,生成硫酸亚铁,铁和硫酸铜反应生成硫酸亚铁和铜,所以固体D中含有铁和铜,加入y后得到硫酸亚铁溶液和铜,所以试剂y的作用是:将铁、铜分离出来。

【题目】为测定某黄铜(铜锌合金)样品中铜的含量,某化学活动小组分三次进行实验,实验数据如表,请回答下列问题:
所取药品 | 第一次 | 第二次 | 第三次 |
黄铜样品质量(g) | 12 | 10 | 10 |
稀盐酸质量(g) | 100 | 100 | 150 |
生成气体质量(g) | 0.2 | 0.2 | 0.2 |
(1)第____次实验中,药品成分恰好完全反应。
(2)黄铜样品中铜的质量分数是多少?恰好完全反应时所得溶液的溶质质量分数是多少________?(精确到0.1%)