题目内容
【题目】在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物X.取一定质量的AgNO3固体充分光照,测得反应后生成Ag、O2、X的质量分别为21.6g、mg、9.2g。下列说法正确的是( )
A. AgNO3固体应密封保存在无色细口瓶中
B. m=3.2
C. X的化学式为NO
D. 该反应方程式中Ag与O2的化学计量数之比为3:2
【答案】B
【解析】
A、硝酸银在光照条件下易分解,应存放于棕色试剂瓶中,错误;B、根据质量守恒定律可知,反应前后元素的种类和质量不会发生改变,硝酸银分解之后银元素全部转移到单质银中,根据单质银的质量可求出反应的硝酸银的质量![]() ,生成氧气的质量为
,生成氧气的质量为![]() ,所以m=3.2,正确;C、生成的氮氧化物中氮元素的质量为
,所以m=3.2,正确;C、生成的氮氧化物中氮元素的质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ,则氮元素和氧元素的个数比为
,则氮元素和氧元素的个数比为![]() ,所以该氮氧化物为NO2,错误;D、根据反应的化学方程式可知Ag与O2的化学计量数之比为2:1,错误。故选B。
,所以该氮氧化物为NO2,错误;D、根据反应的化学方程式可知Ag与O2的化学计量数之比为2:1,错误。故选B。

【题目】FeCl2溶液中混有少量的CuCl2,为了除去CuCl2,某课外小组同学取该溶液50g于烧杯中,然后等量分5次加入某物质M充分反应,所得数据如下表,请根据相关知识和数据回答下列问题:
次数 | 1 | 2 | 3 | 4 | 5 |
加入M的质量(g) | 0.28g | 0.28g | 0.28g | 0.28g | 0.28g |
溶液的总质量(g) | 49.96 g | 49.92 g | 49.88g | 49.84g | 49.84g |
(1)写出物质M的化学式______.
(2)参加反应M的总质量是________?
(3)FeCl2溶液中CuC12的质量分数是_______?
【题目】中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱中和反应进行了如下研究。
(实验过程1)
对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过下图所示实验步骤进行操作。
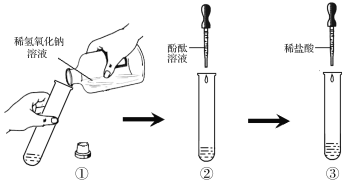
请根据上图所示实验步骤填写实验报告:
实验步骤 | 实验现象 | 实验结论 |
①向试管中加入1~2ml稀氢氧化钠溶液 | NaOH与HCl 发生了中和反应 | |
②_______________ | ______________ | |
③____________ | ______________ |
(实验过程2)
对于某些有明显现象产生的中和反应,如稀盐酸与氢氧化铝的反应,观察到有___的现象,就可以说明中和反应已经发生。该反应的化学方程式为_____。〔提 示:氢氧化铝是不溶于水的白色固体,其化学式为Al(OH)3〕
(实验反思)
(1)有同学提出也可以使用石蕊溶液代替酚酞溶液进行(实验过程1)的实验。你认为______(填“酚酞溶液”或“石蕊溶液”)更适合用于验证稀盐酸与稀氢氧化钠溶液发生中和反应,你的理由是_____。
(2)对于没有明显现象出现的酸碱中和反应,我们可以借助_____的变化,来判断是否反应或反应进行的程度。