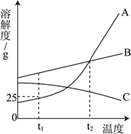
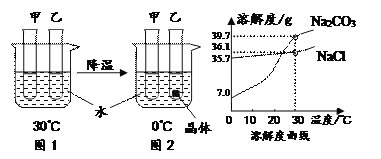
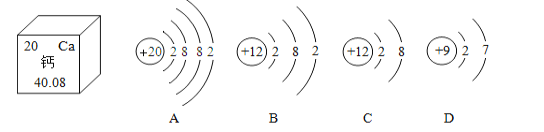
题目内容
【题目】在某次探究活动中,小明同学往NaHCO3溶液中加入NaOH溶液,未观察到明显现象,即认为两者没有发生化学反应,小亮同学却有疑问。
(提出问题)在溶液中,NaHCO3和NaOH真的不反应吗
(猜想假设)(1)溶液中,NaHCO3和NaOH要反应
(2) ________________________;
(查阅资料)(1) 可溶于水的酸、碱、盐在水中能解离出对应的阳离子和阴离子
(2) 部分碱、盐的溶解性表(室温)
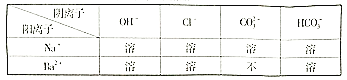
(进行实验)

(解释与结论)(1) 根据实验1中无明显现象,可得到的结论是 _________ (选填字母编号)
A. 混合溶液中没有NaCl B. 混合溶液中没有Ba(HCO3)2;
C. 混合溶液中没有NaHCO3 D. 混合溶液中的阴、阳离子不能形成不溶物
(2) 实验3中生成的沉淀为_____________(填化学式),该沉淀中的阴离子只能来源于实验_____(选填“1”或“2”)所得到的溶液,则实验_____(选填“1”或“2”)必定发生了化学反应,写出该反应的化学方程式____________________。
(3) 依据上述实验及分析,猜想_________成立。
(总结反思)
两种溶液混合,未能观察到明显现象而化学反应_______(选填字母编号)
A.一定没发生 B. 一定发生了 C. 不一定没发生
【答案】 在溶液中,NaHCO3和NaOH不反应 D BaCO3; 2; 2 NaHCO3+NaOH= Na2CO3+H2O 一 C
【解析】
(1)NaHCO3和NaOH要么反应,要么不反应,故猜想2是在溶液中,NaHCO3和NaOH不反应;
(2)实验1将碳酸氢钠和氯化钡混合后没有明显现象,说明混合后没有沉淀生成,故选D;
(3)实验3中碳酸氢钠与氢氧化钠反应生成碳酸钠和水,碳酸钠又于氯化钡反应生成BaCO3沉淀;故碳酸根离子来源于实验2中;故实验2中必定发生了化学反应,碳酸氢钠与氢氧化钠反应生成碳酸钠和水,碳酸钠与氯化钡反应生成碳酸钡沉淀,反应方程式为NaHCO3+NaOH= Na2CO3+H2O;
(4)由上可知,碳酸氢钠与氢氧化钠发生了反应,故猜想一正确;两种溶液混合,未能观察到明显现象有两种可能,一种是发生了反应但是无明显现象,另一种是不发生反应,故选C。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱中和反应进行了如下研究。
(实验过程1)
对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过下图所示实验步骤进行操作。
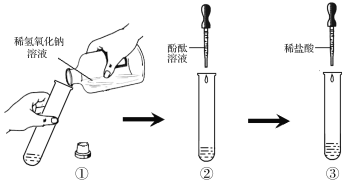
请根据上图所示实验步骤填写实验报告:
实验步骤 | 实验现象 | 实验结论 |
①向试管中加入1~2ml稀氢氧化钠溶液 | NaOH与HCl 发生了中和反应 | |
②_______________ | ______________ | |
③____________ | ______________ |
(实验过程2)
对于某些有明显现象产生的中和反应,如稀盐酸与氢氧化铝的反应,观察到有___的现象,就可以说明中和反应已经发生。该反应的化学方程式为_____。〔提 示:氢氧化铝是不溶于水的白色固体,其化学式为Al(OH)3〕
(实验反思)
(1)有同学提出也可以使用石蕊溶液代替酚酞溶液进行(实验过程1)的实验。你认为______(填“酚酞溶液”或“石蕊溶液”)更适合用于验证稀盐酸与稀氢氧化钠溶液发生中和反应,你的理由是_____。
(2)对于没有明显现象出现的酸碱中和反应,我们可以借助_____的变化,来判断是否反应或反应进行的程度。