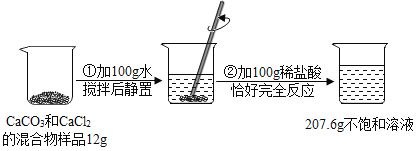
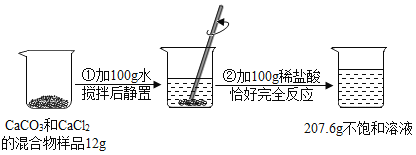
题目内容
【题目】现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为1.22g/cm3的硫酸并做相关记录。关数据记录如下表:
加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
1 | 20.0 | 16.0 |
2 | 20.0 | 12.0 |
3 | 20.0 | 8.0 |
4 | 20.0 | 8.0 |
试计算:
(1)10.0g此样品中铜的质量_____。
(2)样品中氧化亚铁的质量分数_____。
(3)所用硫酸溶液溶质的质量分数_____。
【答案】4 60% 22.3%
【解析】
氧化亚铁和硫酸生成硫酸亚铁和水,铜不会和硫酸反应,氧化亚铁全部参加反应后剩余固体就是铜。
(1)由表中数据可知,铜的质量是8克,则样品中铜的质量分数为![]() ,10克样品中铜的质量为
,10克样品中铜的质量为![]() 。
。
(2)样品中铜的质量分数为40%,则样品中氧化亚铁的质量分数为![]() 。
。
(3)20.0g此样品中氧化亚铁的质量为![]()
设12克氧化亚铁参加反应所需硫酸的质量为x
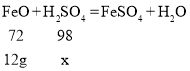
![]()
![]()
硫酸溶液的质量为![]() 。
。
硫酸溶液中溶质的质量分数为![]()
答:(1)10.0g此样品中铜的质量为4克;
(2)样品中氧化亚铁的质量分数为60%;
(3)所用硫酸溶液溶质的质量分数为22.3%。

【题目】现有![]() 的
的![]() 溶液,请按照下面要求计算:
溶液,请按照下面要求计算:
![]() 上述溶液中所含溶质的质量为______。
上述溶液中所含溶质的质量为______。
![]() 上述溶液与足量
上述溶液与足量![]() 的盐酸反应,最多可生成
的盐酸反应,最多可生成![]() 多少克______?
多少克______?
![]() 向106g上述溶液中逐滴加入
向106g上述溶液中逐滴加入![]() 的盐酸并不断搅拌,此时发生的反应为:
的盐酸并不断搅拌,此时发生的反应为:![]() ;当
;当![]() 全部转化为
全部转化为![]() 后,再加入盐酸才开始放出
后,再加入盐酸才开始放出![]() 请在图中画出产生气体的曲线______。
请在图中画出产生气体的曲线______。
![]() 另取
另取![]() 溶液边搅拌边加入
溶液边搅拌边加入![]() 的盐酸,有关反应物与生成物的量如表格:
的盐酸,有关反应物与生成物的量如表格:
物质 |
| HCl | x | NaCl |
|
|
质量 |
|
|
|
|
| m |
则x是______;![]() ______。
______。
【题目】为测定某氮肥中硫酸铵的纯度(即质量分数)是否与如图所示标签相符,小林取一定量该氮肥样品于烧杯中配成溶液,与足量氯化钡溶液反应,记录有关数据如下表:

反应前 | 反应后 | |
烧杯和样品 溶液总质量 | 氯化钡溶 液质量 | 过滤后烧杯和溶液总质量 (滤液的损失忽略不计) |
45 g | 55 g | 76.7 g |
[反应的化学方程式为(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl,其他成分能溶于水但不参加反应]
(1)反应共生成BaSO4的质量为____________g。
(2)若所取氮肥样品的质量为15g,试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符________。(请写出计算过程)
(3)反应前后,溶液中硫元素的质量________(选填“不变”“增大”或“减小”)。