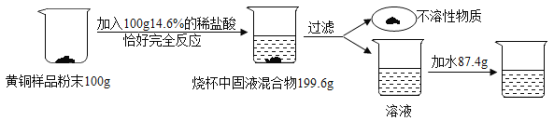
题目内容
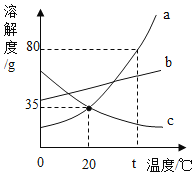
【题目】硝酸钾(KNO3)和氯化钾(KCl)的溶解度曲线如图所示:
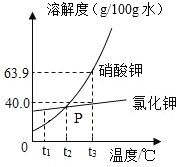
① t1 ℃时,氯化钾的溶解度____________(填“>”、“=”或“<”)硝酸钾的溶解度。
②硝酸钾的溶解度随温度的升高而____________(填“增大”或“减小”)。
③P 点是硝酸钾和氯化钾的两条曲线的交点,其含义是____________。
④若硝酸钾中混有少量氯化钾,提纯硝酸钾采取的方法是____________。
⑤将 t3 ℃时氯化钾的饱和溶液70.0g稀释成溶质质量分数为20.0%的氯化钾溶液,需加水____________g。查阅相关物质的密度后,在实验室完成该实验,通常需要 仪器除烧杯、 胶头滴管外 ,还需____________(填字母标号) 。
A 电子天平
B 药匙
C 量筒
D 玻璃棒
⑥现有 t2 ℃时硝酸钾饱和溶液 m1 g 和氯化钾饱和溶液 m2 g。不考虑水的蒸发,一定成立的是____________(填字母标号)。
A 两溶液中溶质的质量分数相等
B 分别升温至t3 ℃,所得溶液均为不饱和溶液
C 分别降温到t1 ℃,析出 KNO3的质量大于析出 KCl 的质量
D 保持t2 ℃不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等
【答案】> 增大 在t2 ℃时,硝酸钾和氯化钾的溶解度相等 冷却热饱和溶液 30 CD AB
【解析】
(1) 根据溶解度曲线,可知t1 ℃时,氯化钾的溶解度大于硝酸钾的溶解度。
(2)根据溶解度曲线,硝酸钾的溶解度随温度的升高而增大。
(3)P 点是硝酸钾和氯化钾的两条曲线的交点,其含义是在t2 ℃时,硝酸钾和氯化钾的溶解度相等。
(4)由于硝酸钾的溶解度随温度的升高而增大,故提纯硝酸钾采取的方法是冷却热饱和溶液。
(5)将 t3 ℃时氯化钾的饱和溶液,其溶质的质量分数为![]() ,70.0g稀释成溶质质量分数为20.0%的氯化钾溶液,根据稀释定律,设稀释后溶液质量为x,可列出等式
,70.0g稀释成溶质质量分数为20.0%的氯化钾溶液,根据稀释定律,设稀释后溶液质量为x,可列出等式![]() ,x=100g,加水量=100g-70g=30g;稀释过程需要用到烧杯、胶头滴管外、量筒、玻璃棒。
,x=100g,加水量=100g-70g=30g;稀释过程需要用到烧杯、胶头滴管外、量筒、玻璃棒。
(6)
A、t2 ℃时硝酸钾饱和溶液和氯化钾饱和溶液的溶解度相等,两溶液中溶质的质量分数与溶解度成正比,故一定成立;
B、分别升温至t3 ℃,二者的溶解度都变大,因此所得溶液均为不饱和溶液,故一定成立;
C、分别降温到t1 ℃,由于m1 g和 m2 g大小未知,因此无法得知析出 KNO3的质量和析出 KCl 的质量的大小关系,故不成立;
D、保持t2 ℃不变,分别加入等质量的水,由于m1 g和 m2 g大小未知,混匀后所得溶液中溶质的质量分数无法得知。故选AB。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为1.22g/cm3的硫酸并做相关记录。关数据记录如下表:
加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
1 | 20.0 | 16.0 |
2 | 20.0 | 12.0 |
3 | 20.0 | 8.0 |
4 | 20.0 | 8.0 |
试计算:
(1)10.0g此样品中铜的质量_____。
(2)样品中氧化亚铁的质量分数_____。
(3)所用硫酸溶液溶质的质量分数_____。