题目内容
【题目】请根据下图所示的实验过程和提供的数据(假设步骤②产生的气体全部逸出),回答下列问题:
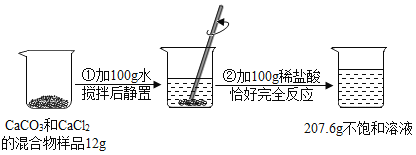
(1)发生反应的化学方程式为___________;
(2)求解12g样品中碳酸钙质量(X)的比例式为____________;
(3)原固体混合物中二者质量的最简整数比为___________ ;
(4)配制上述实验所需的稀盐酸,需要溶质质量分数为36.5﹪的浓盐酸的质量是___________;
(5)在②反应后的溶液中蒸发_____g水,才能得到溶质质量分数为10﹪的氯化钙溶液。
【答案】CaCO3+2HCl=CaCl2+CO2↑+H2O ![]() 5:1或1:5 20g 76.6g
5:1或1:5 20g 76.6g
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,溶液稀释前后,溶质质量不变。
(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,故发生反应的化学方程式为CaCO3↓+2HCl=CaCl2+CO2+H2O。
(2)由质量守恒定律可知,反应中生成二氧化碳的质量为![]()
设反应的碳酸钙质量是X
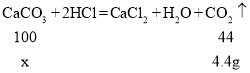
![]()
故12g样品中碳酸钙质量(X)的比例式为![]() 。
。
(3)原固体混合物中碳酸钙的质量为![]() ,氯化钙的质量为
,氯化钙的质量为![]() ,原固体混合物中碳酸钙和氯化钙的最简整数比为
,原固体混合物中碳酸钙和氯化钙的最简整数比为![]() 。
。
(4)设参加反应的氯化氢的质量为y
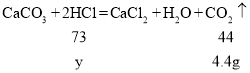
![]()
![]()
故配制实验所需的稀盐酸,需要溶质质量分数为36.5﹪的浓盐酸的质量是![]()
(5)设生成氯化钙的质量为z,蒸发水的质量为m
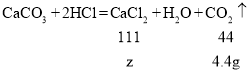
![]()
![]()
![]()
![]()
故在②反应后的溶液中蒸发76.6g水,才能得到溶质质量分数为10﹪的氯化钙溶液。

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为1.22g/cm3的硫酸并做相关记录。关数据记录如下表:
加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
1 | 20.0 | 16.0 |
2 | 20.0 | 12.0 |
3 | 20.0 | 8.0 |
4 | 20.0 | 8.0 |
试计算:
(1)10.0g此样品中铜的质量_____。
(2)样品中氧化亚铁的质量分数_____。
(3)所用硫酸溶液溶质的质量分数_____。